题目内容
5.下列叙述能肯定金属A比金属B更活泼的是( )| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | A原子的电子层数比B原子多 | |
| C. | 1 mol A从酸中置换出H2比1 mol B多 | |
| D. | 常温下,A能从酸中置换出氢气,而B不能 |
分析 比较金属的活泼性可通过以下角度:①与水反应的剧烈程度,②最高价氧化物对应的水化物的碱性,③单质之间的置换反应,④对应阳离子离子的氧化性强弱等,⑤金属活动性顺序表.
解答 解:A.比较金属的活泼性不能根据最外层电子数的多少,如Li的最外层电子数比Ca少,但不如Ca活泼,Na的最外层电子数比Cu少,但Na比Cu活泼,故A错误;
B.比较金属的活泼性不能根据原子电子层数的多少,如Na的电子层数比Cu少,但Na比Cu活泼,故B错误;
C.比较金属的活泼性不能根据生成氢气的多少来判断,例如1molAl从酸中置换H+生成的H2比1molMg从酸中置换H+生成的H2多,但Mg的活泼性强,故C错误;
D.常温时,A能从水中置换出氢,而B不能,说明A易失去电子,则A的活泼性肯定比金属B的活泼性强,故D正确.
故选D.
点评 本题考查金属的活泼性的比较,题目难度不大,注意能找出反例,学习中注意把握相关基础知识的积累.

练习册系列答案
相关题目
16.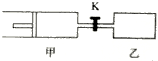 如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
 如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )
如图,甲容器有一个移动活塞,能使弃器保持恒压.起始时向甲中充入2mol SO2、1mol O2,向乙中充入4mol SO2、2mol O2.甲、乙的体积都为1L(连通管体积忽略不计).保持相同温度和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:2SO2(g)+O2(g)?2SO3(g).达平衡时,甲的体积为0.8L.下列说法正确的是( )| A. | 乙容器中SO2的转化率小于60% | |
| B. | 平衡时SO3的体积分数:甲>乙 | |
| C. | 打开K后一段时间.再次达到平衡.甲的体积为1.4 L | |
| D. | 平衡后向甲中再充入2mol SO2、1mol O2.和3moLSO3,平衡向正反应方向移动 |
13.下列溶液:①pH=0的盐酸,②0.5mol/L盐酸,③pH=4的NH4Cl溶液,④0.1mol/L NaOH溶液,由水电离的氢离子物质的量浓度浓度由大到小的顺序正确的是( )
| A. | ①②③④ | B. | ③④②① | C. | ①②③④ | D. | ③④①② |
20.分子式为C8H8O2的有机物,它的同分异构体很多,其中属于芳香族酯类的同分异构体除下列一种外,还有( )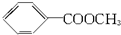

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
10.中学化学中很多“规律”都有适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 元素的非金属性较强,其单质也越活泼 | 磷单质比N2稳定 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓硝酸、稀硝酸,浓硝酸中铝片先溶解完全 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS黑色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
17.根据下列事实:
(1)X+Y2+═X2++Y;
(2)Z+2H2O(冷)═Z(OH)2+H2↑;
(3)由Y、W电极组成的原电池,电极反应为:W2++2e-═W,Y-2e2-═Y2+.
可知X、Y、Z、W的还原性由强到弱的顺序是( )
(1)X+Y2+═X2++Y;
(2)Z+2H2O(冷)═Z(OH)2+H2↑;
(3)由Y、W电极组成的原电池,电极反应为:W2++2e-═W,Y-2e2-═Y2+.
可知X、Y、Z、W的还原性由强到弱的顺序是( )
| A. | X>Z>Y>W | B. | Z>W>X>Y | C. | Z>X>Y>W | D. | Z>Y>X>W |
14.下列化学用语书写正确的是( )
| A. | 溴化钙的化学式:CaBr | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 氟离子的结构示意图: | D. | 四氯化碳的电子式: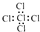 |
15.别向盛有NaBr、KI溶液的试管中,滴加适量氯水,用力振荡后加入少量CCl4,振荡、静置,有关现象描述不正确的是( )
| A. | 原NaBr溶液分层,上层液体呈现橙色 | |
| B. | 原NaBr溶液分层,下层液体呈现橙色 | |
| C. | 原KI溶液分层,上层几乎无色 | |
| D. | 原KI溶液分层,下层呈现紫红色 |