题目内容
12.有A、B、C、D、E五种金属元素.在相同条件下,B元素的最高价氧化物对应水化物的碱性比A的弱;B、C与硫酸构成的原电池中B为负极;D单质可以与冷水剧烈反应并放出氢气;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气.则五种金属元素的金属性由强到弱的顺序为( )| A. | D>B>A>C>E | B. | D>A>B>C>E | C. | A>B>C>E>D | D. | D>E>B>A>C |
分析 B元素的最高价氧化物对应水化物的碱性比A的弱,则金属性B小于A;B、C与硫酸构成的原电池中B为负极,说明B较活泼;D单质可以与冷水剧烈反应并放出氢气,则D的活泼性较强;A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气,则E的活泼性最弱,据此进行解答.
解答 解:相同条件下,B元素的最高价氧化物对应水化物的碱性比A的弱,则金属性A>B;
B、C与硫酸构成的原电池中B为负极,说明B较活泼,则金属性:B>C;
D单质可以与冷水剧烈反应并放出氢气,说明D元素的金属性非常强,应是五种元素中金属性最强的元素;
A、B、C、E四种单质分别投入盐酸中,只有E不放出氢气,则E的活泼性最弱,其金属性最弱;
根据分析可知,五种金属元素的金属性由强到弱的顺序为D>A>B>C>E,
故选B.
点评 本题考查金属性的比较,题目难度不大,本题注意比较金属性强弱的角度和方法,特别注意D可以与冷水剧烈反应并放出氢气,说明D元素的金属性非常强,试题培养了学生的灵活应用能力.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
20.下列说法中正确的是( )
| A. | 常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | |
| B. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | |
| C. | 含1mol硫酸的稀溶液与含1molBa(OH)2的稀溶液完全中和所放出的热量为中和热 | |
| D. | 在25℃、101KPa时,2mol 氢气的燃烧热是1mol 氢气的2倍 |
7.下列反应中,符合如图所示能量变化的是( )
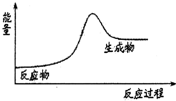

| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
4.下列叙述中正确的是( )
| A. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| B. | 煤经气化和液化等物理变化可转化为清洁燃料 | |
| C. | 以淀粉为原料可制取乙酸乙酯 | |
| D. | 苯和油脂均不能使酸性髙锰酸钾溶液褪色 |
2.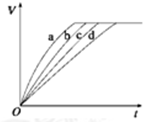 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )| 组别 | 对应曲线 | C(HCl)/mol•L-1 | 反应温度/℃ | 铁的状态 |
| 1 | a | 30 | 粉末状 | |
| 2 | b | 30 | 粉末状 | |
| 3 | c | 2.5 | 块状 | |
| 4 | d | 2.5 | 30 | 块状 |
| A. | 第4组实验的反应速率最慢 | |
| B. | 第1组实验中盐酸的浓度可能最大 | |
| C. | 第2组实验中盐酸的浓度可能等于2.5 mol•L-1 | |
| D. | 第3组实验的反应温度可能低于30℃ |
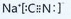 .
. .
.
 某温度时,在2L容器中X.、Y、Z三种物质的物质的量随时间变化曲线
某温度时,在2L容器中X.、Y、Z三种物质的物质的量随时间变化曲线