题目内容
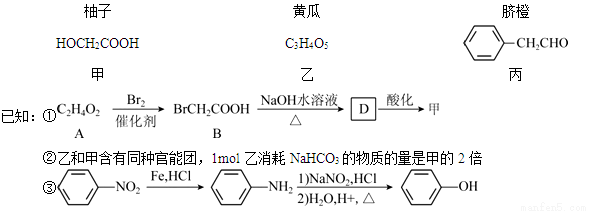
【化学——选修5:有机化学基础】部分果蔬中含有下列成分:
回答下列问题:
(1)甲可由已知①得到。
①甲中含有不饱和键的官能团名称为 ,可以表征有机化合物中存在何种官能团的仪器是 。
②A→B为取代反应,A的结构简式为 。
③B→D的化学方程式为 。
(2)乙在一定条件下能聚合生成链状酯类有机高分子化合物,该反应的化学方程式为_____________。
(3)由丙经下列途径可得一种重要的医药和香料中间体J(部分反应条件略去):

检验丙中官能团的试剂是 ,反应的现象是________________。
②经E→G→H保护的官能团是 ,据此推出E→G两步反应略去的反应物可能为:第一步__________________,第二步____________________。
③J有多种同分异构体。其中某异构体L呈链状且不存在支链,L中的官能团都能与H2 发生加成反应,L在核磁共振氢谱上显示为两组峰,峰面积比为3:2,则L的结构简式为___________(只写一种)。
练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
8.下列反应中,属于氧化还原反应的是( )
| A. | Na2CO3+CaCl2═CaCO3↓+2NaCl | B. | Fe+CuSO4═Cu+FeSO4 | ||
| C. | CaO+H2O═Ca(OH)2 | D. | NaOH+HCl═NaCl+H2O |
下列实验操作、现象及由此得出的结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0 mol·L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
1.氢气是一种清洁能源.科学家探究太阳能制氢技术,设计流程图如图1:

信息提示:以下反应均在150℃发生
2HI(aq)?H2(g)+I2(g )△H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)△H2
2H2SO4(l)?2H2O(g)+2SO2(g)+O2(g)△H3
2H2O(g)=2H2(g)+O2(g)△H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4=2△H1+2△H2+△H3.
(2)该制氢气技术的优点是物质循环利用,能源来自太阳能,无污染且取之不尽用之不竭(两个要点,一个是物质循环、一个是能量),若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H<0(填“>”,“<”或“=”).
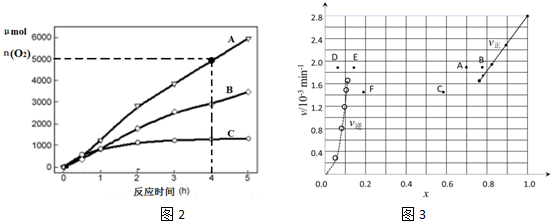
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图2所示.则下列说法正确的是BD.
A.H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea( B )>Ea(C )
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C.0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250mol•h-1
D.不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)?H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
①根据上述实验结果,该反应的平衡常数K的计算式为:$K=\frac{0.108×0.108}{{{{0.784}^2}}}$.
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为k逆=$\frac{K正}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图3表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)

信息提示:以下反应均在150℃发生
2HI(aq)?H2(g)+I2(g )△H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)△H2
2H2SO4(l)?2H2O(g)+2SO2(g)+O2(g)△H3
2H2O(g)=2H2(g)+O2(g)△H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4=2△H1+2△H2+△H3.
(2)该制氢气技术的优点是物质循环利用,能源来自太阳能,无污染且取之不尽用之不竭(两个要点,一个是物质循环、一个是能量),若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H<0(填“>”,“<”或“=”).
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图2所示.则下列说法正确的是BD.
A.H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea( B )>Ea(C )
B.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C.0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250mol•h-1
D.不同催化剂的催化效果不同,是因为活化分子百分数不相同
(4)对于反应:2HI(g)?H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
②上述反应中,正反应速率为v正=k正•x2(HI),逆反应速率为v逆=k逆•x(H2)•x(I2),其中k正、k逆为速率常数,则k逆为k逆=$\frac{K正}{K}$(以K和k正表示).若k正=0.0027min-1,在t=40min时,v正=1.95×10-3min-1
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图3表示.当升高到某一温度时,反应重新达到平衡,相应的点分别为A、E(填字母)



 H++In-(黄色),对上述平衡解释不正确的是
H++In-(黄色),对上述平衡解释不正确的是 
 ,下列说法不正确的是( )
,下列说法不正确的是( )