题目内容
在恒压密闭容器中,当下列物理量不再发生变化时,不能表明反应A(s)+3B(g)=C(g)+2D(g)已达到平衡状态的是( )
| A、混合气体的密度 |
| B、混合气体的总物质的量 |
| C、混合气体的平均相对分子质量 |
| D、体系的温度 |
考点:化学平衡状态的判断
专题:化学平衡专题
分析:当可逆反应达到平衡状态时,正逆反应速率相等,反应体现中各物质的物质的量、物质的量浓度及百分含量都不变,以及由此引起的一些物理量不变,据此分析解答.
解答:
解:A.该反应是一个反应前后气体体积不变的可逆反应,压强不变,容器的体积不变,但反应前后气体质量变化,所以其密度在反应前后发生变化,当混合气体密度不变时该反应达到平衡状态,所以可以作为判断依据,故A不选;
B.该反应是一个反应前后气体体积不变的可逆反应,所以混合气体的总的物质的量始终不变,则混合气体的总物质的量不能作为判断化学平衡的依据,故B选;
C.该反应是一个反应前后气体体积不变的可逆反应,但气体的质量发生变化,所以其平均分子质量发生变化,当混合气体的平均相对分子质量不变时,该反应达到平衡状态,故C不选;
D.任何化学反应都有热量变化,但温度不变时,说明反应达到平衡状态,故D不选;
故选B.
B.该反应是一个反应前后气体体积不变的可逆反应,所以混合气体的总的物质的量始终不变,则混合气体的总物质的量不能作为判断化学平衡的依据,故B选;
C.该反应是一个反应前后气体体积不变的可逆反应,但气体的质量发生变化,所以其平均分子质量发生变化,当混合气体的平均相对分子质量不变时,该反应达到平衡状态,故C不选;
D.任何化学反应都有热量变化,但温度不变时,说明反应达到平衡状态,故D不选;
故选B.
点评:本题考查化学平衡状态的判断,只有反应前后改变的物理量才能作为化学平衡的判断依据,注意方程式的特点、反应热特点,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
| A、将过量的CO2通入Ca(ClO)2溶液中:H2O+CO2+Ca2++2ClO-=CaCO3↓+2HClO |
| B、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-=CO32-+H2O |
| C、Fe3O4与稀HNO3反应:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| D、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-=CaCO3↓+H2O |
下列有关实验的操作和现象描述的对应关系正确的是( )
| A、将NaOH溶液逐滴滴入FeSO4溶液中,只观察到白色沉淀 |
| B、将钠放入水中,钠浮在水面上、熔成一个闪亮的小球、四处游动、溶液变红 |
| C、除去表面保护膜的铝在酒精灯上加热到熔化,熔化的铝以小液滴的形式滴落下来 |
| D、在滴有酚酞溶液的 Na2SiO3溶液中,逐滴加入稀盐酸,溶液的红色逐渐变浅,并有白色胶状物生成 |
下列实验现象预测、实验设计、仪器使用能达到目的是( )
A、 模拟工业制氨气并检验产物 |
B、 分离沸点不同的两种液体 |
C、 收集并吸收多余氯气 |
D、 盛放浓硝酸 |
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
| A、1 mol NH5中含有5 NA个N-H键(NA表示阿伏加德罗常数) |
| B、NH5中既有共价键又有离子键 |
C、NH5的电子式为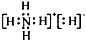 |
| D、它与水反应的离子方程式为NH4++H-+H2O=NH3?H2O+H2↑ |
下列说法正确的是:( )
| A、1mol蔗糖可水解生成2mol葡萄糖 |
| B、CH3-CH=CH-CH3与C3H6一定互为同系物 |
C、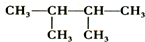 的名称是2,3-甲基丁烷 的名称是2,3-甲基丁烷 |
| D、乙醇可与水以任意比例混溶,是因为相似相溶原理且与水形成了氢键 |
