题目内容
1.下列离子方程式书写正确的是( )| A. | Ca(HCO3)2溶液中滴入过量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向NaAlO2溶液中通入过量的CO2:CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 0.01 mol•L-1 的NH4Al(SO4)2溶液与0.02 mol•L-1的Ba(OH)2溶液等体积混合:Al3++2SO42-+NH4++2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 向Ca(ClO)2溶液中通入过量的SO2:ClO-+SO2+H2O═HClO+HSO3- |
分析 A.反应生成碳酸钙、碳酸钠和水;
B.反应生成氢氧化铝和碳酸氢钠;
C.物质的量比为1:2,反应生成硫酸钡、氢氧化铝和一水合氨;
D.发生氧化还原反应生成硫酸钙.
解答 解:A.Ca(HCO3)2溶液中滴入过量NaOH溶液的离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故A错误;
B.向NaAlO2溶液中通入过量的CO2的离子反应为CO2+2H2O+AlO2-═Al(OH)3↓+HCO3-,故B正确;
C.0.01 mol•L-1 的NH4Al(SO4)2溶液与0.02 mol•L-1的Ba(OH)2溶液等体积混合的离子反应为Al3++2SO42-+NH4++2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O,故C正确;
D.漂白粉溶液中通入过量SO2的离子反应为Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故D错误;
故选BC.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、与量有关的离子反应及氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
11.下列叙述错误的是( )
| A. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| B. | 用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用金属钠可区分乙醇和乙醚 |
12.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-,现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.792L(已换算成标准状况,且设气体全部逸出);②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )
| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32- 一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
9.某有机物A的结构为(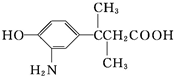 ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )
 ),下列关于A的叙述中错误的是( )
),下列关于A的叙述中错误的是( )| A. | 该物质在一定条件下能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱(1H-NMR)上共有7个峰 | |
| C. | 1 mol该物质最多能与含1 mol Br2的溴水发生取代反应 | |
| D. | 该物质能与Na、NaOH、NaHCO3、盐酸等物质反应 |
16.下列说法正确的是( )
| A. | 任意两原子间均能形成化学键 | |
| B. | 由两个非金属原子形成的化合物中不可能存在离子键 | |
| C. | 任何化学键的变化必然伴有着电子的得失 | |
| D. | 某化合物的水溶液能导电,则该化合物中一定存在离子键 |
13.已知分解1mol KClO3放出热量38.8kJ,在MnO2下加热,KClO3的分解机理为:
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
①2KClO3+4MnO2═2KCl+2Mn2O7 慢
②2Mn2O7═4MnO2+3O2 快
下列有关说法不正确的是( )
| A. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 | |
| B. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| C. | KClO3分解速率快慢主要取决于反应② | |
| D. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 |
10.在50mL试管中充满15mL Cl2和35mL H2,受强光照射一定时间后,试管倒立在冷水中,进入试管中的水的体积是( )
| A. | 30mL | B. | 25mL | C. | 20mL | D. | 0mL |