题目内容
9.铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康.(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如图1所示:
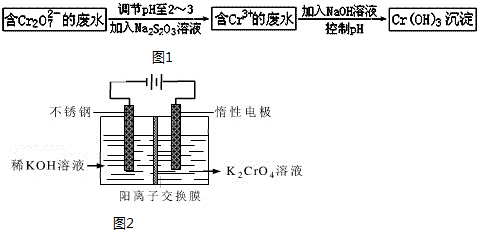
Na2S2O3在此过程中表现还原性.若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为+3价,反应的离子方程式为Cr3++4OH-=CrO2-+2H2O.
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车.其反应原理如下,请配平该反应方程式:2CrO3+3CH3CH2OH+3H2SO4-1CH3CHO+3Cr2(SO4)3+6H2O
(3)已知存在平衡:2CrO42-+2H+?Cr2O72-+H2O.向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(任意写出其中一种即可).
此时溶液中c(Pb2+):c(Ba2+)=2.2×10-3.
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图2所示(阳离子交换膜只允许阳离子透过).通电后阳极的电极反应式为2H2O-4e-=O2↑+4H+(或4OHˉ-4e-=O2↑+2H2O).请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因阴极室发生反应2H2O+2e-=H2↑+2OHˉ,c(OHˉ)增大;K+穿过阳离子交换膜进入阴极室,与OHˉ共同得到KOH.
分析 (1)Na2S2O3与六价铬发生氧化还原反应将六价的还原成+3价,所以Na2S2O3是还原剂,NaCrO2中Cr元素的化合价为+3价,向含Cr3+的废水中加入过量NaOH溶液,反应方程式为:Cr3++4OH-=CrO2-+2H2O;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,其转移电子总数为6,根据转移电子相等、原子守恒配平方程式;
(3)加入Ba(NO3)2和Pb(NO3)2溶液,平衡:2CrO42-+2H+?Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+,$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=$\frac{{K}_{sp}(PbCr{O}_{4})}{{K}_{sp}(BaCr{O}_{4})}$,由此分析解答;
(4)阳极发生氧化反应,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O,阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室.
解答 解:(1)Na2S2O3与六价铬发生氧化还原反应将六价的还原成+3价,所以Na2S2O3是还原剂,NaCrO2中Cr元素的化合价为+3价,向含Cr3+的废水中加入过量NaOH溶液,反应方程式为:Cr3++4OH-=CrO2-+2H2O,故答案为:还原;+3;Cr3++4OH-=CrO2-+2H2O;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,根据转移电子相等知,CrO3的计量数是2,C2H5OH的计量数是3,再结合原子守恒配平方程式为:2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O,
故答案为:2;3;3;1;3;6;
(3)加入Ba(NO3)2和Pb(NO3)2溶液,平衡:2CrO42-+2H+?Cr2O72-+H2O向逆反应方向移动,所以反应的离子方程式为Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+(或Cr2O72-+H2O+2Pb2+=2PbCrO4↓+2H+,$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=$\frac{{K}_{sp}(PbCr{O}_{4})}{{K}_{sp}(BaCr{O}_{4})}$=$\frac{2.75×1{0}^{-13}}{1.25×1{0}^{-10}}$=2.2×10-3,
故答案为:Cr2O72-+H2O+2Ba2+=2BaCrO4↓+2H+;2.2×10-3;
(4)阳极发生氧化反应,电极反应式为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O,阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室,
故答案为:2H2O-4e-=O2↑+4H+(或4OH--4e-=O2↑+2H2O);阴极室发生反应2H2O+2e-=H2↑+2OH-,c(OH-)增大;K+穿过阳离子交换膜进入阴极室,与OH-共同得到KOH.
点评 本题考查了物质分离与提纯方法及其综合应用用,题目难度中等,涉及难溶电解质的溶解平衡、氧化还原反应的计算以及化学方程式的书写、沉淀溶解平衡的理解与计算等知识,明确实验目的及实验原理为解答关键,试题培养了学生的分析、理解能力及化学实验能力.

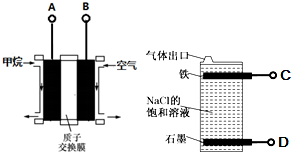
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | A电极的电极反应式为:CH4-8e-+2H2O=CO2+8H+ | |
| C. | 燃料电池工作时H+移向左边 | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 次氯酸 | Ka1=2.98×10-8 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
(2)往六种盐溶液中分别通入少量SO2,请判断是否能反应,如果能,写出相应化学方程式SO2+H2O+2CH3COONa=2CH3COOH+Na2SO3、SO2+H2O+3NaClO=Na2SO3+2HClO+NaCl、SO2+2NaHCO3=Na2SO3+2CO2↑+H2O、SO2+H2O+Na2CO3=NaHCO3+NaHSO3、SO2+H2O+Na2SO3=2NaHSO3.
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | NaHCO3溶液与NaAlO2溶液混合 | 生成白色沉淀 | 结合H+的能力: CO32-<AlO2- |
| B | 常温下,相同的铝片分别投入足量的稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越快 |
| C | 向2mL 2%的CuSO4溶液中加入0.5mL 1%的NaOH溶液,振荡后加入几滴有机试剂X的溶液,加热 | 未出现砖红色沉淀 | 有机试剂X中不含醛基 |
| D | 2mL 0.1mol/L的NaOH溶液中滴加2滴0.1mol/L的MgCl2溶液,再滴加2滴0.1mol/L的FeCl3溶液 | 白色沉淀转化为红褐色沉淀 | 溶解度: Mg(OH)2>Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
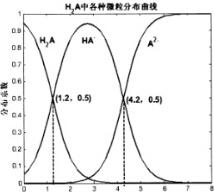 常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )
常温下0.1mol/L的H2A溶液中H2A、HA-、A2-三者中所占物质的量分数(分数系数)随pH变化的关系如图所示.下列表述不正确的是( )| A. | H2A?2H++A2- K=10-5.4 | |
| B. | 在0.1mo/LNaHA溶液中,各离子浓度大小关系为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| C. | 已知25℃时HF的Ka=10-3.45,将少量H2A的溶液加入足量的NaF溶液中,发生的反应为:H2A+F-═HF+HA- | |
| D. | 将等物质的量的NaHA、Na2A溶于水中,所得溶液pH恰好为4.2 |
| A. | 17g羟基和17gOH-含有的电子数均为10NA | |
| B. | 2L0.5 mol•L-1醋酸溶液中含有的H+数为NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4L | |
| D. | 7.8gNa2O2与足量的CO2和H2O(g)混合气体充分反应,转移的电子数为0.1NA |
 近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施:
近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体.为减少“雾霾”的发生,可采取以下措施: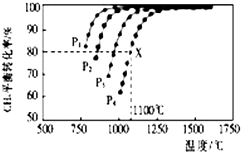 在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.
在密闭容器中通入物质的量浓度均为0.1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)?2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示.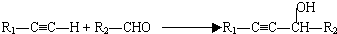 (R代表烃基,下同.)
(R代表烃基,下同.)
 .
.