题目内容
水煤气法制甲醇工艺流程框图如图:
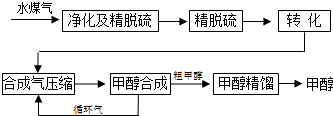
(1)制水煤气的化学反应为:C(s)+H2O(g)CO(g)+H2(g),△H>0
①此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ?mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
①比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol?L-1,则该时间内反应速率v(CH3OH)= mol-1?(Lmin)-1.
(3)生产过程中,合成气要进行循环,其目的是 .

(1)制水煤气的化学反应为:C(s)+H2O(g)CO(g)+H2(g),△H>0
①此反应的化学平衡常数表达式为
②下列能增大碳的转化率的措施是
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)合成气经压缩升温后进入甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应如下:2H2(g)+CO(g) CH3OH(g);△H=-90.8kJ?mol-1,T4℃下此反应的平衡常数为160.此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/mol?L-1 | 0.2 | 0.1 | 0.4 |
②若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4mol?L-1,则该时间内反应速率v(CH3OH)=
(3)生产过程中,合成气要进行循环,其目的是
考点:化学平衡的影响因素,化学平衡的调控作用
专题:化学平衡专题
分析:(1)①根据平衡常数等于生成物浓度的幂次方之积比上反应物浓度的幂次方之积;
②根据平衡向正反应方向移动,增大碳的转化率;
(2)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②根据氢气的浓度计算甲醇的浓度变化量,再根据v=
计算v(H2);
③合成气进行循环,可以提高原料利用率.
②根据平衡向正反应方向移动,增大碳的转化率;
(2)①计算此时的浓度商Qc,与平衡常数比较,判断反应进行的方向,据此解答;
②根据氢气的浓度计算甲醇的浓度变化量,再根据v=
| △c |
| △t |
③合成气进行循环,可以提高原料利用率.
解答:
解:(1)①此反应的化学平衡常数表达式为,K=
;故答案为:
;
②平衡向正反应方向移动,增大碳的转化率,所以A、加入C(s)平衡不移动,B、加入H2O(g),C、升高温度,平衡向正反应方向移动,碳的转化率增大,D、增大压强,平衡向逆反应方向移动;故选:BC;
(2)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
=100,小于平衡常数160,故反应向正反应方向进行,故V正>V逆,故答案为:>;
②由表中数据可知,c(H2)=0.4mol?L-1,l0min内甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
=0.03mol/(L?min),
故答案为:0.03;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
②平衡向正反应方向移动,增大碳的转化率,所以A、加入C(s)平衡不移动,B、加入H2O(g),C、升高温度,平衡向正反应方向移动,碳的转化率增大,D、增大压强,平衡向逆反应方向移动;故选:BC;
(2)①由表中数据可知,10min时氢气的浓度为0.2mol/L、CO的浓度为0.1mol/L、甲醇的浓度为0.4mol/L,则此时的浓度商Qc=
| 0.4 |
| 0.2 2×0.1 |
②由表中数据可知,c(H2)=0.4mol?L-1,l0min内甲醇的浓度变化量为0.3mol/L,故v(CH3OH)=
| 0.3mol/L |
| 10min |
故答案为:0.03;
③生产过程中,合成气要进行循环,这样可以提高原料利用率,故答案为:提高原料利用率(或提高产量、产率亦可).
点评:本题考查化学平衡常数、化学平衡影响因素、反应速率计算等,难度中等,注意理解掌握平衡常数的用途.

练习册系列答案
相关题目
醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,下列叙述不正确的是( )
| A、醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-) |
| B、0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)增大 |
| C、CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动 |
| D、pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH>7 |
两种物质以任意质量比混合,如混合物的质量一定,充分燃烧时产生的二氧化碳的量是定值,则混合物的组成可能是( )
| A、乙醇、丙醇 |
| B、乙醇、乙二醇 |
| C、1-丙醇、丙二醇 |
| D、乙烯、丙烯 |
现有①MgSO4,②Ba(NO3)2,③NaOH,④CuCl2,⑤KCl五种溶液,不加任何其他试剂,被鉴别出的先后顺序正确的是( )
| A、④③①②⑤ |
| B、④⑤③②① |
| C、④③②①⑤ |
| D、④②③①⑤ |
下列热化学方程式中的△H能表示物质燃烧热的是( )
| A、2CO(g)+O2(g)═2CO2(g);△H=-556kJ?mol-1 | ||
| B、CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890kJ?mol-1 | ||
C、H2(g)+
| ||
| D、H2(g)+Cl2(g)═2HCl(g);△H=-184.6kJ?mol-1 |

 中和滴定:
中和滴定: