题目内容
已知25℃时醋酸的电离常数为1.0×10-5.计算0.1mol/L的醋酸溶液里的H+的物质的量浓度?
考点:弱电解质在水溶液中的电离平衡
专题:
分析:根据醋酸的电离结合平衡常数的公式来分析求解.
解答:
解:设电离的醋酸浓度为x,
则:CH3COOH?CH3COO-+H+
初始 0.1 0 0
反应 x x x
平衡 0.1-x x x
所以 K=
=
=1.0×10-5,
由于x很小,所以 0.1-x≈0.1,即x2=1.0×10-5×0.1,x=1.0×10-2mol/L,
所以H+的物质的量浓度1.0×10-2mol/L,
答:H+的物质的量浓度为:1.0×10-2mol/L.
则:CH3COOH?CH3COO-+H+
初始 0.1 0 0
反应 x x x
平衡 0.1-x x x
所以 K=
| c(H+)c(CH3COO-) |
| c(CH3COOH) |
| x2 |
| 0.1-x |
由于x很小,所以 0.1-x≈0.1,即x2=1.0×10-5×0.1,x=1.0×10-2mol/L,
所以H+的物质的量浓度1.0×10-2mol/L,
答:H+的物质的量浓度为:1.0×10-2mol/L.
点评:本题考查了弱电解质的电离,根据电离平衡常数公式来分析解答,为易错点.

练习册系列答案
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
下列有关实验的说法错误的是( )
| A、做银镜反应实验后的试管内壁附有银,可用稀硝酸清洗 |
| B、向MgCl2溶液中滴加NaOH溶液,产生白色沉淀,再加入FeCl3溶液,沉淀逐渐变为红褐色 |
| C、用0.1mol/L的酸性KMnO4溶液配成的溶液滴定一定质量的草酸晶体(H2C2O4?nH2O)以测定其n值,若终点仰视读数,则n值偏大 |
| D、环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小 |
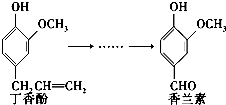 香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )
香兰素是重要的香料之一,它可由丁香酚经多步反应合成.有关上述两种化合物的说法正确的是( )| A、常温下,1 mol丁香酚只能与1 mol Br2反应 |
| B、香兰素分子中至少有12个原子共平面 |
| C、1 mol香兰素最多能与3 mol氢气发生加成反应 |
| D、香兰素和丁香酚都不能与银氨溶液发生反应 |
下列措施中肯定能使化学反应速率增大的是( )
| A、增大反应物的量 | B、增大压强 |
| C、降低温度 | D、升高温度 |
100mL 1mol/L H2SO4跟过量锌粉反应,恒温下,为减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量某物质或溶液,其中不能达到目的是( )
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
①醋酸钠(固体) ②水 ③硫酸钾溶液 ④硫酸铵(固体)⑤100mL 2mol/L硫酸氢铵溶液 ⑥将1mol/L硫酸改为18mol/L硫酸 ⑦硝酸钾溶液⑧将锌粉改为锌块.
| A、①③④⑥ | B、④⑤⑥⑦ |
| C、①②③⑧ | D、③④⑤⑦ |
20mLCaCl2溶液加水稀释至100mL,稀释后的溶液中Cl-离子的物质的量浓度为1mol/L,则稀释前CaCl2的物质的量浓度为( )
| A、2.5mol/L |
| B、5mol/L |
| C、1.25 mol/L |
| D、2mol/L |




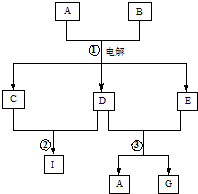 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)