题目内容
8.溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质.实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如图1:完成下列填空:
(1)上述使用的氢溴酸(HBr溶液)的质量分数为26%,若用47%的氢溴酸配制1.2mol/L的氢溴酸的氢溴酸500mL,所需的玻璃仪器有玻璃棒、量筒、烧杯、胶头滴管、500mL容量瓶.
(2)已知步骤Ⅲ的滤液中不含NH4+.步骤Ⅱ加入的试剂a是石灰水,步骤Ⅳ的目的是除去过量的氢氧化钙.
(3)步骤Ⅴ所含的操作依次是蒸发浓缩、冷却结晶、过滤、冷水洗涤.
冷水洗涤的目的是洗去晶体表面可溶性杂质,减少晶体损失.
(4)某工业尾气中含有CO、CO2、SO2气体,利用如图2装置对尾气进行分步吸收(不转化)或收集.
①A中盛放的溶液是d(填字母).
a.NaOH 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
②C中收集的气体是CO(填化学式).
③B中盛有苛性钠溶液,写出该反应的离子方程式:CO2+2OH-=CO32-+H2O(或CO2+OH-=HCO3-).
分析 工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙,工业大理石加入氢溴酸酸溶生成溴化钙、溴化铝、溴化铁,然后向溶液中加入试剂a,目的是除去Al3+和Fe3+,除杂时要除去杂质且不引进新的杂质,Al3+和Fe3+能和碱反应生成沉淀,所以a应该选取石灰水;然后过滤,滤去沉淀;向滤液中加入氢溴酸,目的是除去过量的氢氧化钙,最后将溶液蒸发浓缩、冷却结晶、过滤得到CaBr2•6H2O;最后加热固体得到较纯净的CaBr2;
(1)根据仪器的用途选取仪器;
(2)已知步骤Ⅲ的滤液中不含NH4+,步骤Ⅱ加入的试剂a要除去,Al3+和Fe3+且不能引进新的杂质;滤液中含有过量的氢氧化钙,影响溴化钙制取,所以要除去过量氢氧化钙;
(3)从溶液中获取晶体应该采用蒸发浓缩、冷却结晶、过滤方法;洗涤的目的是洗去晶体表面的杂质;
(4)某工业尾气中含有CO、CO2、SO2气体,利用如图2装置对尾气进行分步吸收(不转化)或收集,二氧化硫和二氧化碳都是酸性氧化物,能和碱反应,二氧化硫还具有还原性,CO是不成盐氧化物,且不溶于水.
解答 解:工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙,工业大理石加入氢溴酸酸溶生成溴化钙、溴化铝、溴化铁,然后向溶液中加入试剂a,目的是除去Al3+和Fe3+,除杂时要除去杂质且不引进新的杂质,Al3+和Fe3+能和碱反应生成沉淀,所以a应该选取石灰水;然后过滤,滤去沉淀;向滤液中加入氢溴酸,目的是除去过量的氢氧化钙,最后将溶液蒸发浓缩、冷却结晶、过滤得到CaBr2•6H2O;最后加热固体得到较纯净的CaBr2;
(1)上述使用的氢溴酸(HBr溶液)的质量分数为26%,若用47%的氢溴酸配制1.2mol/L的氢溴酸的氢溴酸500mL,所需的玻璃仪器除了玻璃棒、量筒、烧杯外,还需要定容的胶头滴管,配制溶液的500mL容量瓶,故答案为:胶头滴管、500mL容量瓶;
(2)已知步骤Ⅲ的滤液中不含NH4+,步骤Ⅱ加入的试剂a要除去,Al3+和Fe3+且不能引进新的杂质,则应该选取石灰水溶液;滤液中含有过量的氢氧化钙,影响溴化钙制取,所以要除去过量氢氧化钙,则IV的目的是除去过量的氢氧化钙,
故答案为:石灰水;除去过量的氢氧化钙;
(3)从溶液中获取晶体应该采用蒸发浓缩、冷却结晶、过滤方法;在晶体表面吸附有杂质,所以洗涤的目的是洗去晶体表面的杂质,减少晶体损失,故答案为:冷却结晶;洗去晶体表面可溶性杂质,减少晶体损失;
(4)某工业尾气中含有CO、CO2、SO2气体,利用如图2装置对尾气进行分步吸收(不转化)或收集,二氧化硫和二氧化碳都是酸性氧化物,能和碱反应,二氧化硫还具有还原性,CO是不成盐氧化物,且不溶于水;①因为要分步处理,应该先除去二氧化硫,二氧化硫具有还原性,应该用强氧化性物质除杂,且不能引进新的杂质,所以用高锰酸钾溶液吸收二氧化硫,故选d;
②然后用碱液吸收二氧化碳,则B吸收二氧化碳,CO不溶于水,且不和酸性高锰酸钾、碱液反应,所以C中收集到的气体是CO,
故答案为:CO;
③二氧化碳是酸性氧化物,能和氢氧化钠反应生成盐和水,离子反应方程式为CO2+2OH-=CO32-+H2O(或CO2+OH-=HCO3-),
故答案为:CO2+2OH-=CO32-+H2O(或CO2+OH-=HCO3-).
点评 本题考查物质制备,为高频考点,侧重考查学生实验操作、整体分析能力,需要学生有较扎实的基本知识、基本操作能力,明确各个步骤实验原理及物质性质是解本题关键,题目难度中等.

| A. | 断裂3NA个碳碳双键时,放出3260kJ的热量 | |
| B. | 消耗336L O2时,放出6520kJ的热量 | |
| C. | 转移30NA个电子时,放出3260kJ的热量 | |
| D. | 生成3NA个气态水分子时,放出3260kJ的热量 |
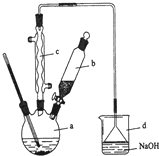 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)写出实验室合成溴苯的化学反应方程式:
 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$ +HBr.
+HBr.(2)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.由b向a中滴入几滴溴,有白雾产生,是因为生成了气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2.
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是干燥.
(4)在该实验中,a的容积最适合的是B(填入正确选项前的字母).
A.25mL B.50mL C.250mL D.500mL.
| A. |  根据图可判断可逆反应 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  图表示压强对可逆反应2A (g)+2B (g)?2AB3 (g)的影响,乙的压强大 | |
| C. |  图可以表示对某化学平衡体系改变温度后反应速率随时间的变化 | |
| D. |  图④是N2与H2合成氨的能量变化曲线,可确定该反应1 molN2和4mol H2充分反应时放热一定小于92kJ |







