题目内容
3.室温下,下列离子组在指定溶液中一定能大量共存的是( )| A. | 加入铝屑有氢气放出的溶液中:Na+、Fe2+、NO3-、SO42- | |
| B. | 常温下pH=12的溶液中:K+、Na+、CO32-、AlO2- | |
| C. | 在葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ | |
| D. | 常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-14的溶液中:Al3+、NH4+、Cl-、HCO3- |
分析 A.加入铝屑有氢气放出的溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下氧化亚铁离子;
B.常温下pH=12的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应;
C.葡萄糖分子中含有羟基和醛基,高锰酸根离子在酸性条件下能够氧化葡萄糖;
D.常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-14的溶液中存在大量氢离子,铝离子、氢离子都与碳酸氢根离子反应.
解答 解:A.加入铝屑有氢气放出的溶液呈酸性或碱性,Fe2+与氢氧根离子反应,Fe2+、NO3-之间在酸性条件下发生氧化还原反应,在溶液中一定不能大量共存,故A错误;
B.常温下pH=12的溶液呈碱性,溶液中存在大量氢氧根离子,K+、Na+、CO32-、AlO2-之间不发生反应,都不与氢氧根离子反应,在溶液中能够大量共存,故B正确;
C.MnO4-、H+具有强氧化性,能够氧化葡萄糖,在溶液中不能大量共存,故C错误;
D.常温下$\frac{c(O{H}^{-})}{c({H}^{+})}$=10-14的溶液呈酸性,溶液中存在大量氢离子,Al3+、HCO3-之间发生双水解反应,HCO3-与氢离子反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案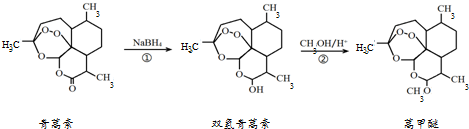
下列说法不正确的是( )
| A. | 青蒿素的分子式是C15H21O5 | |
| B. | 青蒿素在NaOH溶液中可以发生水解反应 | |
| C. | 反应②有H2O生成 | |
| D. | 青蒿素分子内的“-O-O-”基团可能对疟原虫有抑制作用 |
| A. | H2SO4 | B. | C2H5OH | C. | HNO3 | D. | NaOH |
| A. | 在0.1 mol•L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 在0.1 mol•L-1NaClO溶液中:c(OH-)=c(H+)+c(HClO) | |
| C. | 25℃时,0.1 mol•L-1CH3COOH溶液中滴入NaOH溶液,使溶液pH=7时:c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| D. | 已知酸性:HCOOH>CH3COOH,浓度均为0.1 mol•L-1的HCOOK与CH3COONa溶液中:c(K+)-c(HCOO-)>c(Na+)-c(CH3COO-) |
| 装置 | 序号 | 试管中的药品 | 现象 |
持续通入 | 实验Ⅰ | 1.5mL 1mol•L-1 CuSO4溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有砖红色沉淀出现,一段时间后,砖红色沉淀消失,静置,试管底部有少量紫红色固体,溶液呈绿色 |
| 实验Ⅱ | 1.5mL 1mol•L-1 CuCl2溶液和3.5mL 1mol•L-1 NaOH溶液混合 | 开始时有黄色沉淀出现,一段时间后,黄色沉淀消失,静置,生成大量白色沉淀,溶液呈绿色 |
(2)甲同学重新用实验II的方法制备新制Cu(OH)2悬浊液,过滤,用蒸馏水洗涤干净.向洗净后的Cu(OH)2中加入5mL蒸馏水,再持续通入SO2气体,现象与实验I相同,此步实验证明:黄色沉淀消失,生成大量白色沉淀(或实验II与实验I的现象差异)与Cl-有关(或与SO42-无关).
检验Cu(OH)2洗涤干净的方法是取最后一次洗涤液于试管中,向其中滴加少量硝酸酸化的AgNO3溶液,不出现白色沉淀,证明Cu(OH)2洗涤干净.
(3)同学们对白色沉淀的成分继续进行探究.查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸.它与氨水反应生成Cu(NH3)2+,在空气中会立即被氧化成含有蓝色Cu(NH3)42+溶液.
①甲同学向洗涤得到的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为:CuCl+2NH3•H2O═Cu(NH3)2++Cl-+2H2O、4Cu(NH3)2++8NH3•H2O+O2═4Cu(NH3)42++4OH-+6H2O.
②乙同学用另一种方法证明了该白色沉淀为CuCl,实验方案如图:
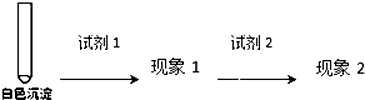
填写如表空格:
| 试剂1 | 试剂2 | 蒸馏水 | |
| 现象1 | 现象2 |
(4)丙同学通过实验证明实验Ⅰ中观察到的砖红色沉淀是Cu2O.完成合理的实验方案:取少量Cu2O固体于试管中,加5mL蒸馏水,向其中持续通入SO2,一段时间后,静置,试管底部有少量紫红色固体,溶液呈绿色(或现象与实验I相同),则说明砖红色沉淀是Cu2O.
环节一:理论推测
部分同学认为Br2和I2都可能将Fe2+氧化为Fe3+,他们思考的依据是均为第ⅤⅡA单质,氧化性均较强.
部分同学认为Br2和I2都不能将Fe2+氧化为Fe3+,还有同学认为Br2能将Fe2+氧化为Fe3+而I2不能.他们思考的依据是从上到下卤素单质氧化性减弱.
环节二:设计实验进行验证
在大试管中加适量铁粉,加入10mL 稀盐酸,振荡试管,充分反应后,铁粉有剩余,取上层清液进行下列实验.
实验1:
| 试管 | 操作 | 现象 |
| ① | 先向试管中加入2mL FeCl2溶液,再滴加少量红棕色的溴水,振荡试管 | 溶液为黄色 |
| ② | 先向试管中加入2mL FeCl2溶液,再滴加少量棕黄色的碘水,振荡试管 | 溶液为黄色 |
(1)同学甲认为①中现象说明溴水能将Fe3+氧化,离子方程式为2Fe2++Br2=2Fe3++2Br-.
同学乙认为应该补充实验,才能得出同学甲的结论.请你帮助同学乙完成实验:
实验2:
| 操作 | 应该观察到的现象 |
可能1:碘水与FeCl2溶液不反应,黄色是碘水稀释后的颜色.
可能2:碘水与FeCl2溶液发生反应,但FeCl3溶液也是黄色的,所以没有明显现象.
实验3:进行实验以确定可能的原因
| 操作 | 现象 |
| 向试管②所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后.取出上层溶液,滴加KSCN 溶液 | 静置后,上层溶液几乎无色,下层溶液为紫色;上层溶液滴加KSCN 溶液后,出现浅红色 |
实验4:
| 操作 | 现象 |
| 向另一支试管中加入2mL FeCl2溶液,滴加0.5mL碘水后,再加入0.5mL 乙酸乙酯,充分振荡,静置一段时间后.取出下层溶液,滴加KSCN 溶液 | 静置后,上层液为紫色,下层液几乎无色;下层溶液滴加KSCN溶液后,没有出现浅红色 |
同学丁根据实验4现象得出结论:在本次实验条件下,碘水与FeCl2溶液反应的程度很小.
(3)Cl2、Br2、I2氧化Fe3+的能力逐渐减弱,用原子结构解释原因:同一主族元素从上到下原子核外电子层数依次增多,原子半径逐渐增大,得电子能力逐渐减弱,氧化性减弱.
| A. | 分子式为C6H6 | B. | 属于不饱和烃 | C. | 能在空气中燃烧 | D. | 无色无毒的液体 |
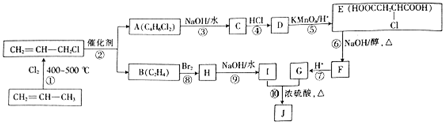
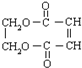 .
. +3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.
+3NaOH$→_{△}^{醇}$NaOOC-CH=CH-COONa+NaCl+3H2O.