题目内容
已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.请回答下列问题:
(1)Z的离子结构示意图是 ;
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1.其化学式中含有的化学键有 .
(3)YX3分子的空间构型是 ,Z的氢化物的稳定性比W的氢化物的稳定 性 (填“强”或“弱”).
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z2W2的电子式为 .
(1)Z的离子结构示意图是
(2)X、Y、W可组成一化合物,其原子个数之比为4:1:1.其化学式中含有的化学键有
(3)YX3分子的空间构型是
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z2W2的电子式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,据此解答.
解答:
解:X、Y、Z、W四种短周期元素的原子序数依次增大,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素;X的原子序数小于N元素,与N元素形成的常见化合物为气体,则X为H元素;Y的核电荷数为7,与W的最外层电子数相同,W处于ⅦA族,Z的原子序数小于W,周期表中W与Z左右相邻,则Z处于ⅥA族,H元素与Z、W所形成的常见化合物在常温下均呈气态,则Z为S元素、W为Cl元素,
(1)Z为S元素,S2-离子有16个电子,核外有18个电子,各层电子数为2、8、8,S2-离子结构示意图为 ,
,
故答案为: ;
;
(2)H、N、Cl可组成一化合物,其原子个数之比为4:1:1,该化合物为NH4Cl,含有的化学键有离子键、共价键,
故答案为:离子键、共价键;
(3)YX3为NH3其分子的空间构型是三角锥形,非金属性越强,则氢化物越稳定,非金属性:Cl>S,则稳定性:HCl>H2S,所以Z的氢化物的稳定性比W的氢化物的稳定弱;
故答案为:三角锥;弱;
(4)S2Cl2分子中,Cl与S均满足8e-稳定结构,S原子之间形成1对共用电子对、每个S原子与Cl原子之间形成1对共用电子对,其电子式为: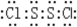 ,
,
故答案为: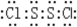 .
.
(1)Z为S元素,S2-离子有16个电子,核外有18个电子,各层电子数为2、8、8,S2-离子结构示意图为
 ,
,故答案为:
 ;
;(2)H、N、Cl可组成一化合物,其原子个数之比为4:1:1,该化合物为NH4Cl,含有的化学键有离子键、共价键,
故答案为:离子键、共价键;
(3)YX3为NH3其分子的空间构型是三角锥形,非金属性越强,则氢化物越稳定,非金属性:Cl>S,则稳定性:HCl>H2S,所以Z的氢化物的稳定性比W的氢化物的稳定弱;
故答案为:三角锥;弱;
(4)S2Cl2分子中,Cl与S均满足8e-稳定结构,S原子之间形成1对共用电子对、每个S原子与Cl原子之间形成1对共用电子对,其电子式为:
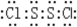 ,
,故答案为:
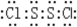 .
.
点评:本题考查学生利用原子结构来推断元素,然后利用原子的结构分析元素的位置、电子式、物质的性质,题目难度中等,侧重于基础知识的应用的考查.

练习册系列答案
相关题目
一定条件下,在体积为2L的密闭容器中,3molX和3mol Y发生反应:3X(g)+Y(g)?2Z(g),经60s达到平衡,生成0.4mol Z.下列说法正确的是( )
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
下列实验能获得成功的是( )
| A、用溴水鉴别苯、乙醇、己烯、四氯化碳 |
| B、加浓溴水,后过滤除去苯中少量苯酚 |
| C、苯、溴水、铁粉混合制成溴苯 |
| D、可用分液漏斗分离溴乙烷和甲苯 |
25℃时,由水电离出的c(H+)=1×10-14 mol?L-1的溶液中,一定能大量共存的离子组是( )
| A、K+、ClO-、SO42-、HCOO- |
| B、Na+、K+、Cl-、NO3- |
| C、NH4+、Al3+、NO3-、Cl- |
| D、Fe2+、Cu2+、NO3-、SO42- |

 X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.