题目内容
短周期元素X、Y、Z、W、Q在元素周期表的位置如下表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
| X | Y | ||
| Z | W | Q |
| A、钠与Y可能形成Na2Y2化合物 |
| B、Z最高价氧化物对应水化物酸性强于W最高价氧化物对应水化物酸性 |
| C、单质的氧化性:W>Q |
| D、原子半径:X>Y |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:X元素原子的内层电子数是最外层电子数的一半,X原子只能有2个电子层,最外层电子数为4,则X为碳元素;由元素在周期表中的位置可知,Y为O、Z为Si、W为S、Q为Cl,据此解答.
解答:
解:X元素原子的内层电子数是最外层电子数的一半,X原子只能有2个电子层,最外层电子数为4,则X为碳元素;由元素在周期表中的位置可知,Y为O、Z为Si、W为S、Q为Cl,
A.Y为氧元素,钠与氧可能形成Na2O2,故A正确;
B.同周期自左而右非金属性增强,最高价含氧酸的酸性增强,故B错误;
C.非金属性S<Cl,故单质氧化性:氯气>硫,故C错误;
D.同周期自左而右原子半径减小,故原子半径X>Y,故D正确,
故选AD.
A.Y为氧元素,钠与氧可能形成Na2O2,故A正确;
B.同周期自左而右非金属性增强,最高价含氧酸的酸性增强,故B错误;
C.非金属性S<Cl,故单质氧化性:氯气>硫,故C错误;
D.同周期自左而右原子半径减小,故原子半径X>Y,故D正确,
故选AD.
点评:本题考查结构性质位置关系应用,确定X是解题关键,注意掌握元素周期表的结构及元素周期律,难度不大.

练习册系列答案
 孟建平名校考卷系列答案
孟建平名校考卷系列答案
相关题目
 如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是( )| A、NH4Al(SO4)2 |
| B、KAl(SO4)2 |
| C、Al2(SO4)3 |
| D、NaAlO2 |
图象是一种简洁表示化学变化过程的方法,下列相关反应的图象中错误的是( )
A、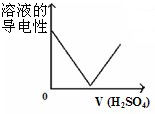 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 将一定量稀硫酸滴入到同浓度的Ba(OH)2溶液中 |
B、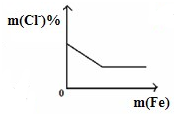 将铁粉加入到一定量FeCl3溶液中 将铁粉加入到一定量FeCl3溶液中 |
C、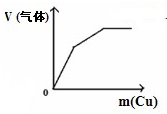 将铜粉加入到一定量浓硝酸中 将铜粉加入到一定量浓硝酸中 |
D、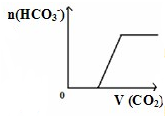 将二氧化碳通入到一定量漂粉精溶液中 将二氧化碳通入到一定量漂粉精溶液中 |