题目内容
1.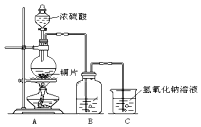 如图为足量铜与浓硫酸反应的装置.请回答:
如图为足量铜与浓硫酸反应的装置.请回答:(1)写出盛放有铜片的仪器名称圆底烧瓶.
(2)检查装置气密性的操作为连接好装置,关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热(或用手掌紧捂圆底烧瓶外壁),如果导管口产生气泡,停止微热后(或移开手掌后)导管内形成一段稳定的水柱,说明气密性良好.
(3)下列有关该实验的说法中正确的是AD.
A.烧杯中氢氧化钠溶液的作用是吸收尾气,防止空气污染
B.实验时可以观察到圆底烧瓶中溶液由无色最终变为蓝色
C.含 0.08mol 溶质的浓硫酸与足量的铜片反应,能收集到896mL(标准状况)的SO2
D.在该实验中浓硫酸体现了酸性和强氧化性
E.如果 B 中盛有少量 KMnO4 溶液,反应一段时间后,可以观察到紫色褪去,说明SO2具有漂白性.
分析 浓硫酸具有强氧化性,在加热条件下与铜发生氧化还原反应生成二氧化硫气体,B可用于检验二氧化硫性质的装置,C为尾气处理装置,防止二氧化硫污染空气.
(1)铜放在圆底烧瓶中;
(2)关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热,观察导管内是否形成一段稳定的水柱;
(3)A.二氧化硫可与氢氧化钠溶液反应;
B.浓硫酸具有吸水性,反应液浓度较大,不能观察到铜离子的颜色;
C.稀硫酸与铜不反应;
D.反应生成硫酸铜和二氧化硫,反应中浓硫酸被还原;
E.二氧化硫和高锰酸钾发生氧化还原反应.
解答 解:(1)由仪器的图形可知铜放在圆底烧瓶,故答案为:圆底烧瓶;
(2)检验仪器的气密性,可利用压强差原理,操作方法是连接好装置,关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热(或用手掌紧捂圆底烧瓶外壁),如果导管口产生气泡,停止微热后(或移开手掌后)导管内形成一段稳定的水柱,说明气密性良好,
故答案为:连接好装置,关闭分液漏斗旋塞,将导管末端插入水中,给圆底烧瓶微热(或用手掌紧捂圆底烧瓶外壁),如果导管口产生气泡,停止微热后(或移开手掌后)导管内形成一段稳定的水柱,说明气密性良好;
(3)A.二氧化硫可与氢氧化钠溶液反应,可用于吸收二氧化硫,防止污染空气,故A正确;
B.浓硫酸具有吸水性,反应液浓度较大,不能观察到铜离子的颜色,应在反应后加水稀释,故B错误;
C.随着反应的进行,浓硫酸的浓度逐渐降低,稀硫酸与铜不反应,故C错误;
D.反应生成硫酸铜和二氧化硫,反应中浓硫酸被还原,浓硫酸表现氧化性和酸性,故D正确;
E.二氧化硫和高锰酸钾发生氧化还原反应,二氧化硫表现还原性,故E错误.
故答案为:AD.
点评 本题考查了浓硫酸的化学性质、二氧化硫的性质及检验方法,为高频考点,侧重考查学生的分析能力和实验能力,题目难度中等,注意掌握浓硫酸的化学性质.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验填空:
(1)将含1mol A的溶液与含1mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为Na2CO3 .
(2)写出实验②发生反应的离子方程式:Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═AlO2-+2H2O.
(3)C常用作净水剂,用离子方程式表示其净水原理:Al3++3H2O?Al(OH)3(胶体)+3H+.
 室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )
室温下,将0.10mol•L-1的盐酸滴入20mL0.10mol•L-1的氨水中,溶液的pH和pOH随加入盐酸体积变化的曲线如图所示.已知:pOH=-lg c(OH-),下列说法正确的是( )| A. | M点所示的溶液中c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| B. | Q点所示的溶液中c(NH4+)>c(Cl-)>c(H+)=c(OH-) | |
| C. | N点所示的溶液中c(NH4+)=c(Cl-) | |
| D. | M点和N点所示的溶液中水的电离程度相同 |
| A. | H+、NO3-、Fe2+、Na+ | B. | Ag+、K+、I-、Cl- | ||
| C. | K+、Ba2+、OH-、SO42- | D. | K+、Cu2+、Br-、OH- |
| A. | 标准状况下,22.4L C2H4与C3H6混合气体所含有分子数为NA | |
| B. | 1L 0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| C. | 1mol Na2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18g NH4+所含的电子数11NA |
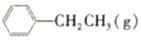 ?
?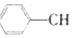 =CH2(g)+H2(g)
=CH2(g)+H2(g)经一段时间后达到平衡,反应过程中测定的部分数据如表所示:
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0% | |
| B. | 反应在前20分钟的平均速率为v(H2)=0.008molmol/( L•min) | |
| C. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v正>v逆 |
| A. | 工业上生产玻璃、水泥均需要用石灰石做原料 | |
| B. | 双氧水、高锰酸钾溶液可以杀灭病毒,其消毒原理与二氧化硫漂白丝织物原理相同 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 石油分馏、煤的干馏、海水晒盐、从菜籽中提取菜籽油等过程都是物理变化 |