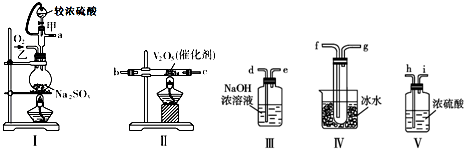
题目内容
5.2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )| A. | 用“绿色化学”工艺,使原料完全转化为目标产物 | |
| B. | 推广燃煤脱硫技术,减少SO2污染 | |
| C. | 推广垃圾的分类存放、回收、处理 | |
| D. | 大量使用农药化肥以提高粮食产量 |
分析 A.根据“绿色化学”的内涵来判断;
B.根据二氧化硫导致酸雨分析;
C.根据废旧电池和电子垃圾等对环境的危害判断;
D.大量使用农药化肥会造成土壤污染、水体污染、大气污染.
解答 解:A.用“绿色化学”工艺,使原料完全转化为目标产物,可以实现节能降耗、保护环境,故A正确
B.燃煤生成二氧化硫,加大酸雨的产生,则推广燃煤脱硫技术,防治SO2污染,可开发太阳能、风能、氢能等新能源,减少化石能源的使用,可以减少污染,符合节能降耗、保护环境的思想,故B正确;
C.废旧电池或电子垃圾中含有重金属等污染物,除贵重金属的其余废料填埋,会造成环境污染,应进行回收、处理,则推广垃圾的分类存放、回收、处理,故C正确;
D.化肥农药的不合理使用,会造成土壤污染、水体污染、大气污染,故D错误;
故选D.
点评 本题考查环境污染及生活污染的处理,注意化学来源于生产、生活,也应服务于生产、生活,注重化学与生活的联系,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
13.在无色透明的强酸性溶液中,下列各组离子能大量共存的是( )
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
20.某研究性学习小组在网上收集到如下信息:钠、镁等活泼金属都能在CO2气体中燃烧,他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计实验方案验证假设】该小组对燃烧后的白色产物进行如下探究:
【思考与交流】
(1)写出金属镁与二氧化碳反应的化学反应方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是Na2CO3溶液显碱性,也会使酚酞变红,且也有可能是Na2O和Na2CO3的混合物.
(3)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.
(4)通过方案1和方案2的实验,你认为上述三个假设中,假设2成立.你的理由是方案2①中出现的白色沉淀是CaCO3或Ca(OH)2;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在,所以燃烧后的白色产物中仅有Na2CO3,白色沉淀为CaCO3.
(5)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2CO3+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素,违背质量守恒定律.
【实验】将燃烧的钠迅速伸入装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
【提出假设】
假设1:白色物质是Na2O.
假设2:白色物质是Na2CO3.
假设3:白色物质是Na2O和Na2CO3的混合物.
【设计实验方案验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验 方案 | 实验操作 | 实验 现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物 质为 Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显 现象 |
(1)写出金属镁与二氧化碳反应的化学反应方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)甲同学认为方案1得到的结论不正确,其理由是Na2CO3溶液显碱性,也会使酚酞变红,且也有可能是Na2O和Na2CO3的混合物.
(3)乙同学认为方案2得到的结论正确,白色物质为Na2CO3.
(4)通过方案1和方案2的实验,你认为上述三个假设中,假设2成立.你的理由是方案2①中出现的白色沉淀是CaCO3或Ca(OH)2;方案2②中滴加无色酚酞试液无明显现象,说明燃烧后的白色产物中没有Na2O存在,所以燃烧后的白色产物中仅有Na2CO3,白色沉淀为CaCO3.
(5)钠在二氧化碳中燃烧的化学方程式为4Na+3CO2=2Na2CO3+C.
(6)丙同学认为白色物质有可能是氢氧化钠.你是否同意丙同学的观点,并简述理由:不同意,因为反应物中无氢元素,违背质量守恒定律.
17.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
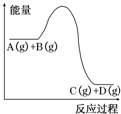

| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
14.下列混合物分离(或除杂)的方法正确的是( )
| A. | Na2SO4溶液中混有少量CuSO4的杂质可用适量的KOH除去 | |
| B. | Na2CO3固体中含有少量NaHCO3杂质可用加热的方法提纯 | |
| C. | Fe(NO3)3中混有少量Fe(NO3)2的杂质可加入适量的氯水除去 | |
| D. | 可以用分液的方法分离CCl4和水 |
15.将50g溶质质量分数为w1,物质的量浓度为c1的浓硫酸沿玻璃棒加入到Vml水中,稀释后得到溶质质量分数为w2,物质的量浓度为c2的稀溶液.下列说法中正确的是( )
| A. | 若c1=2c2,则w1<2w2,V<50 mL | B. | 若c1=2c2,则w1<2w2,V>50 mL | ||
| C. | 若w1=2w2,则c1<2c2,V=50 mL | D. | 若w1=2w2,则c1>2c2,V<50 mL |