题目内容
下列电离方程式书写正确的是( )
| A、NH3?H2O=OH-+NH4+ |
| B、NaHSO4=Na++HSO4- |
| C、H2S?H++HS- |
| D、H2CO3?2H++CO32- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等;强电解质完全电离,弱电解质部分电离,多元弱酸分步电离.
解答:
解:A、NH3?H2O是弱电解质部分电离要用可逆号表示,正确的离子方程式为:NH3?H2O?OH-+NH4+,故A错误;
B、NaHSO4是强电解质,在溶液中完全电离,正确的离子方程式为:NaHSO4=Na++H++SO42-,故B错误;
C、H2S是多元弱酸分步电离,以第一步电离为主,电离方程式正确,故C正确;
D、H2CO3是多元弱酸分步电离,以第一步电离为主,正确的离子方程式为:H2CO3?H++HCO3-,故D错误.
故选C.
B、NaHSO4是强电解质,在溶液中完全电离,正确的离子方程式为:NaHSO4=Na++H++SO42-,故B错误;
C、H2S是多元弱酸分步电离,以第一步电离为主,电离方程式正确,故C正确;
D、H2CO3是多元弱酸分步电离,以第一步电离为主,正确的离子方程式为:H2CO3?H++HCO3-,故D错误.
故选C.
点评:本题考查了电离方程式正误的判断,注意把握强电解质、弱电解质和多元弱酸的电离方程式的书写方法,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
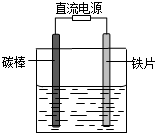 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )
如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象.下列叙述正确的是( )| A、碳棒接直流电源的负极 |
| B、碳棒上发生还原反应 |
| C、铁片附近出现的浑浊物是Mg(OH)2 |
| D、铁片上的电极反应式为2Cl--2e-=Cl2↑ |
在通常条件下,下列性质排列正确的是( )
| A、熔点:MgO>KCl>SiO2>CO2 |
| B、水中溶解性:HCl>NH3>H2S>SO3 |
| C、热稳定性:HF>H2O>NH3 |
| D、沸点:戊烷>2-甲基丁烷>乙烷>丁烷 |
在标准状况下,2.2g由CH4和C2H4组成的混合气体所占的体积为2.24L,则该混合气体中CH4和C2H4的质量比是( )
| A、1:1 | B、4:7 |
| C、7:4 | D、1:2 |
一定量的NaHCO3和Na2CO3混合物,向其中加入500mLHCl溶液后溶液呈中性,产生标况下CO2气体4.48L,若将等量的NaHCO3和Na2CO3混合物加热后,产生气体用碱石灰吸收,碱石灰增重4.65g,则下列叙述正确的是( )
| A、加热时生成的气体在标况下3.36L |
| B、NaHCO3和Na2CO3混合物质量为17.9g |
| C、加热时若用浓硫酸吸收气体则浓硫酸增重3.3g |
| D、HCl溶液的浓度为0.6mol/L |
下列关于蛋白质的叙述中,不正确的是( )
| A、向蛋白质溶液里加(NH4)2SO4溶液可提纯蛋白质 |
| B、在豆浆中加入少量的石膏,能使豆浆凝结为豆腐 |
| C、温度越高,酶对某些化学反应的催化效率越高 |
| D、当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒 |
下列有机物中属于烷烃的是( )
| A、C6H12(环己烷) |
| B、C8H18(汽油的主要成分) |
| C、C8H8(立方烷) |
| D、CHBrClCF3(一种麻醉剂) |
若NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、100mL 1mol/L NaHCO3溶液含有0.1NA个HCO3- |
| B、常温常压下,1mol氦气含有2NA个原子 |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、加热条件下,1molCl2与足量Fe粉充分反应,转移的电子数为3NA |
已知化学反应2C(s)+O2(g)
2CO(g),2CO(g)+O2(g)
2CO2(g)都是放热反应,据此判断,下列说法中不正确的是(其他条件相同)( )
| ||
| ||
| A、12 g碳所具有的能量一定高于28 g CO所具有的能量 |
| B、56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量 |
| C、12 g C和32 g O2所具有的总能量大于44 g CO2所具有的总能量 |
| D、将一定质量的C燃烧,生成CO2比生成CO时放出的热量多 |