题目内容
17.为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
(1)上述实验中第⑤步操作需要烧杯、玻璃棒、漏斗等玻璃仪器.
(2)判断BaCl2已过量的方法是向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量.
(3)第④步中所有相关的化学方程式是CaCl2+Na2CO3=CaCO3↓+2NaCl、BaCl2+Na2CO3=BaCO3↓+2NaCl.
(4)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
分析 由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,
(1)第⑤步为过滤操作;
(2)可用硫酸盐检验钡离子;
(3)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;
(4)加入试剂产生的沉淀氢氧化镁、氢氧化铁以及碳酸钙均会溶于盐酸中,不能先加盐酸再过滤.
解答 解:(1)过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为:烧杯、玻璃棒、漏斗,故答案为:玻璃棒;漏斗;
(2)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:向②步后的上层清液中再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(3)过量碳酸钠可将溶液中的杂质离子钙离子以及多余的钡离子除去,反应方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl,BaCl2+Na2CO3=BaCO3↓+2NaCl,故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;BaCl2+Na2CO3=BaCO3↓+2NaCl;
(4)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度.
点评 本题考查物质分离、提纯实验方案的设计,把握粗盐提纯流程中的分离方法及发生的离子反应为解答的关键,侧重分析能力及物质除杂的考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
2.实验一:实验室制备苯甲酸的反应装置图1和有关数据如下:
按下列合成步骤回答问题:
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸晶体.
(1)球形冷凝管的作用是冷凝回流,
(2)分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
(3)分离出的苯甲酸晶体中可能含有的杂质是KMnO4、K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
实验二:实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器.请回答下列问题:
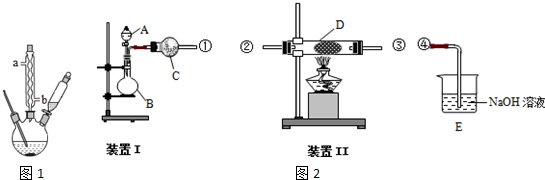
(1)①仪器B中应加入的固体药品Na2O2(填化学式);
②D中发生反应的化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②此时仪器C中改为盛装P2O5的作用是干燥SO2气体.
| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
在三颈瓶中加入4mL甲苯和20mL稀硫酸,放入碎瓷片后,加热至沸腾,加入12.8g高锰酸钾,加热到甲苯层消失.将三颈瓶在冰水浴中冷却,分离出苯甲酸晶体.
(1)球形冷凝管的作用是冷凝回流,
(2)分离苯甲酸选用的玻璃仪器是BCD(填标号)
A分液漏斗 B玻璃棒 C烧杯 D漏斗 E蒸馏烧瓶 F直形冷凝管
(3)分离出的苯甲酸晶体中可能含有的杂质是KMnO4、K2SO4、MnSO4,为进一步提纯,应采用的方法是重结晶.
实验二:实验室用装置Ⅰ制氨气和氧气的混合气体,A中装有浓氨水,C中盛有碱石灰;用装置Ⅱ验证氨的某些性质,D内放置催化剂(铂石棉),按气流方向①→②→③→④连接各仪器.请回答下列问题:

(1)①仪器B中应加入的固体药品Na2O2(填化学式);
②D中发生反应的化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(2)若用装置Ⅰ制取干燥的SO2气体,则:
①B中发生反应的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
②此时仪器C中改为盛装P2O5的作用是干燥SO2气体.
 .该反应中的氧化剂是二氧化锰.
.该反应中的氧化剂是二氧化锰.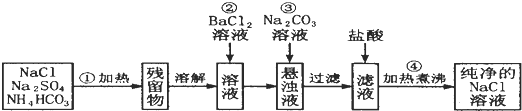
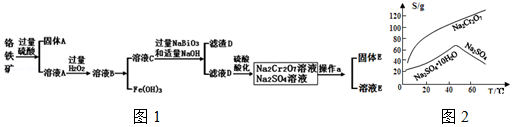
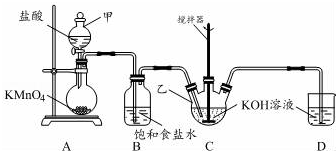 实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4.
实验室用图所示装置制备KClO溶液,并通过KClO溶液与Fe(NO3)3溶液的反应制备高效水处理剂K2FeO4. 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.