题目内容
20.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 将0.1mol•L-1Na2CO3溶液与0.1mol•L-1NaHCO3溶液等体积混合:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3) | |
| C. | 将0.1mol•L-1NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 将0.1mol•L-1Na2C2O4溶液与0.1mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
分析 A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,依据溶液中电荷守恒分析判断;
B.根据物料守恒分析;
C.将0.1mol•L-1NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7),氨水的电离程度大于铵根离子的水解程度;
D.根据电荷守恒分析.
解答 解:A.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),c(H+)>c(OH-),c(Na+)<c(CH3COO-),故A错误;
B.该溶液中钠离子与含有C原子的微粒存在物料守恒,钠离子浓度和含有C原子的微粒的浓度之和的比为3:2,碳酸根离子水解生成碳酸氢根离子、碳酸氢根离子水解生成碳酸,所以含有C原子的微粒有CO32-、HCO3-、H2CO3,所以存在的物料守恒为2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3),故B正确;
C.将0.1mol•L-1NH4Cl溶液与0.1mol•L-1氨水等体积混合(pH>7),氨水的电离程度大于铵根离子的水解程度,所以c(NH4+)>c(NH3•H2O),故C错误;
D.将0.1mol•L-1Na2C2O4溶液与0.1mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸),溶液中电荷守恒为:2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+),故D错误.
故选B.
点评 本题考查溶液中守恒关系的应用,明确溶液中存在的微粒成分及各个浓度之间关系是解本题关键,任何电解质溶液中都存在电荷守恒和物料守恒、质子守恒,与电解质溶液浓度大小无关,题目难度中等.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案
相关题目
10.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 7.8gNa2O2固体中含离子总数为0.4NA | |
| B. | 2.0gH218O和D216O的混合物中所含中子数为NA | |
| C. | 常温下,22.4LCH4中含C-H共价键数为4NA | |
| D. | 标准状况下,11.2LCCl4中含有的分子数为0.5NA |
11.用分液漏斗可以分离的一组液体混合物是( )
| A. | 硝基苯和水 | B. | 苯和溴苯 | C. | 汽油和苯 | D. | 溴和CCl4 |
5.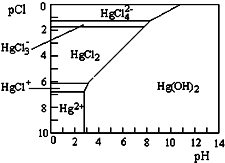 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
 水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )
水体中二价汞离子可以与多种阴离子结合成不同的存在形态.水溶液中二价汞主要存在形态与Cl-、OH-的浓度关系如图所示[注:粒子浓度很小时常用负对数表示,如pH=-lgc(H+),pCl=-lgc(Cl-)],下列说法错误的是( )| A. | 正常海水(Cl-的浓度大于0.1mol•L-1)中汞元素的主要存在形态是HgCl42- | |
| B. | 少量Hg(NO3)2溶于0.001mol•L-1的盐酸后,汞元素的主要存在形态是HgCl2 | |
| C. | 将Hg(NO3)2固体直接溶于水中配制溶液 | |
| D. | 可用废铜屑处理含Hg2+的废水,其离子方程式为Cu+Hg2+═Cu2++Hg |
12.25℃时某0.1mol/L的一元弱酸(用HA表示),未电离的弱酸分子(HA)的物质的量与电离生成的阴、阳离子总物质的量之比为4.5:1,则此溶液( )
| A. | 电离度α为10% | B. | α=20% | ||
| C. | pH=1 | D. | c(OH-)=1×10-12mol/L |
9.对于有气体参加的化学反应,下列说法正确的是( )
| A. | 增大压强,活化分子百分数增大,化学反应速率一定增大 | |
| B. | 升高温度,活化分子百分数增大,化学反应速率一定增大 | |
| C. | 加入反应物,活化分子百分数增大,化学反应速率增大 | |
| D. | 使用催化剂,降低了反应的活化能,增大了活化分子百分数,化学反应速率一定增大 |
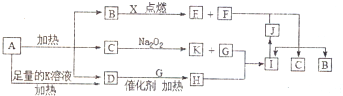
 ,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
,写出F的一种同素异形体金刚石(C60、石墨等),D分子的空间构型为三角锥形.
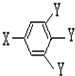 (其中:-X、-Y均为官能团)
(其中:-X、-Y均为官能团)