题目内容
已知1mol烯烃A完全燃烧需要3mol氧气.某烃B是A的同系物,在常温常压下,10mL气态烃B跟50mL足量氧气混合并点燃,完全反应后恢复到原来状态,测得剩余气体体积为30mL.求:
(1)烃A的化学式为 (不写计算过程);
(2)通过计算确定烃B的化学式和它所有可能的结构简式.(写计算过程)
(1)烃A的化学式为
(2)通过计算确定烃B的化学式和它所有可能的结构简式.(写计算过程)
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:(1)根据烯烃的燃烧关系式计算出烯烃A的结构简式;
(2)根据差量法计算出B的分子式,然后根据同分异构体的书写方法写出B可能的结构简式.
(2)根据差量法计算出B的分子式,然后根据同分异构体的书写方法写出B可能的结构简式.
解答:
解:(1)1mol烯烃A完全燃烧需要3mol氧气,设烯烃的分子式为:CnH2n,烯烃燃烧的关系式为:CnH2n~(n+
)O2,则n+
=3,解得:n=2,该烯烃为:C2H4,
故答案为:C2H4 ;
(2)B是A的同系物,则B为烯烃,设B的分子式为:CnH2n,则:
CnH2n+(n+
)O2
nCO2+nH2O△n,
1 (n+
) n 1+
10mL 10mL+50mL-30mL=30mL
(1+
)×10mL=1×30mL,
解得:n=4,
B的分子式为:C4H8,
B为丁烯,丁烯的结构简式有:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、CH2=C(CH3)2,
答:B的化学式为C4H8;B可能的结构简式为:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、CH2=C(CH3)2 .
| n |
| 2 |
| n |
| 2 |
故答案为:C2H4 ;
(2)B是A的同系物,则B为烯烃,设B的分子式为:CnH2n,则:
CnH2n+(n+
| n |
| 2 |
| 点燃 |
1 (n+
| n |
| 2 |
| n |
| 2 |
10mL 10mL+50mL-30mL=30mL
(1+
| n |
| 2 |
解得:n=4,
B的分子式为:C4H8,
B为丁烯,丁烯的结构简式有:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、CH2=C(CH3)2,
答:B的化学式为C4H8;B可能的结构简式为:CH2=CH-CH2-CH3、CH3-CH=CH-CH3、CH2=C(CH3)2 .
点评:本题考查了有机物分子式、结构简式的计算、同分异构体的书写,题目难度中等,注意掌握确定有机物分子式的方法,明确同分异构体的概念及计算方法,能够利用差量法确定有机物B的分子式.

练习册系列答案
相关题目
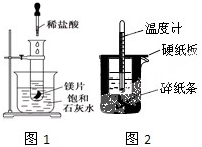 某学习小组设计以下实验,探究化学反应中的热效应.
某学习小组设计以下实验,探究化学反应中的热效应.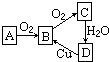 在通常情况下,A是单质,A、B、C、D均含有同一种元素,它们的相互转化关系如图所示.
在通常情况下,A是单质,A、B、C、D均含有同一种元素,它们的相互转化关系如图所示.