题目内容
13.下列各溶液中,微粒的物质的量浓度关系正确的是( )| A. | 10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| B. | 0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl) | |
| D. | 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-) |
分析 A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合,反应后溶液中溶质为CH3COOH、NaCl、HCl,醋酸是弱酸存在电离平衡,据此分析离子浓度大小;
B.0.1mol•L-1pH为4的NaHB溶液,显酸性,则HB-的电离大于其水解;
C.相同温度、相同浓度的这两种盐溶液,碳酸根离子促进铵根离子水解、铵根离子水解程度越大,则溶液中铵根离子浓度越小,溶质浓度越大;
D.溶液中电荷守恒分析,阳离子所带电荷总数等于阴离子所带电荷总数.
解答 解:A.10mL0.5mol/LCH3COONa溶液与6mL1mol/L盐酸混合发生反应,CH3COONa+HCl=CH3COOH+NaCl,得到溶液中溶质为CH3COOH、NaCl、HCl,溶液显酸性,离子浓度大小为:c(Cl-)>c(Na+)>c(H+)>c(OH-),故A错误;
B.0.1mol•L-1pH为4的NaHB溶液,显酸性,HB-的电离大于其水解,电离生成B2-,水解生成H2B,则c(B2-)>c(H2B),故B错误;
C.相同温度、相同浓度的这三种盐溶液,硫酸铵和碳酸铵溶液中铵根离子浓度大于氯化铵溶液中铵根离子浓度,氯化铵溶液浓度最大,碳酸根离子水解显碱性促进铵根离子水解,铵根离子水解程度越大,则溶液中铵根离子浓度越小,c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液,溶质浓度大小为:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl),故C正确;
D.溶液中电荷守恒可知,在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理、弱电解质的电离及其影响为解答关键,注意掌握电荷守恒、盐的水解原理在判断离子浓度大小中的应用方法,试题培养了学生的灵活应用能力.

 阅读快车系列答案
阅读快车系列答案| A. | NH4+、Na+、Br-、SO42- | |
| B. | Al3+、Cl-、OH-、HCO3- | |
| C. | pH=0的溶液中:ClO-、SO42-、Fe2+、K+ | |
| D. | 由水电离的c(OH-)=10-14mol•L-1的溶液中:CH3COO-、SO42-、Na+、NH4+ |
| A. | NH4HCO3 | B. | NH4HSO4 | C. | NH4NO3 | D. | CH3COONH4 |
| A. | 试管、蒸发皿 | B. | 试管、烧杯 | C. | 试管、平底烧瓶 | D. | 蒸发皿、圆底烧瓶 |
| A. | 用食醋清洗热水瓶中的水垢;用米汤检验碘盐中含有碘酸钾 | |
| B. | 小苏打可中和胃酸,热纯碱溶液可除油污;小苏打和纯碱可以用石灰水鉴别 | |
| C. | 用丁达尔效应区别鸡蛋白溶液和食盐水 | |
| D. | “84消毒液”和洁厕剂能同时使用,除污垢效果更好 |
| A. | 稀有气体、浓硫酸、胆矾 | B. | 金刚石、石灰石、铁矿石 | ||
| C. | 天然气、碱式碳酸铜、液氧 | D. | 石墨、熟石灰、水煤气 |
| A. | 升高温度平衡向正反应方向移动 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 该反应的△S<0 |
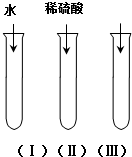 氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.
氧化铜(CuO)是一种黑色固体,可溶于稀硫酸中.某同学想知道是稀硫酸中的H2O、H+和SO42-中的哪种粒子能使氧化铜溶解.请你和他一起通过如图所示三个实验来完成这次探究活动.