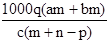题目内容
4.测定市售过氧化氢溶液中H2O2的质量分数.(1)量取10.00mL密度为ρ g/mL的市售过氧化氢溶液,应选用酸式滴定管(填“酸式滴定管”或“碱式滴定管”);
(2)将上述溶液配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250mL容量瓶、胶头滴管(填名称);
(3)取25.00mL(2)中的溶液于锥形瓶中,用稀H2SO4酸化,并加适量蒸馏水稀释,用高锰酸钾标准液滴定.
①完成反应的离子方程式:
2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑
②重复滴定三次,平均消耗C mol/L KMnO4标准液V mL,则原过氧化氢溶液中H2O2的质量分数为$\frac{17CV}{200ρ}$.
分析 (1)过氧化氢具有氧化性,可氧化腐蚀橡胶;
(2)配制成250.00mL,一定需要250mL容量瓶,还需要胶头滴管定容;
(3)①Mn元素的化合价由+7降低为+2,O元素的化合价应从-1价升高为0,结合电子、电荷守恒分析;
②结合2KMnO4~5H2O2计算.
解答 解:(1)过氧化氢具有氧化性,可氧化腐蚀橡胶,则选酸式滴定管,故答案为:酸式滴定管;
(2)配制成250.00mL,配制过程需用到的玻璃仪器是烧杯、玻璃棒、250mL容量瓶,还需要胶头滴管定容,故答案为:250 mL容量瓶、胶头滴管;
(3)①Mn元素的化合价由+7降低为+2,O元素的化合价应从-1价升高为0,由电子、电荷、原子守恒可知,离子反应为2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2↑,
故答案为:2;5;6;2;8;5O2↑;
②n(KMnO4)=VC×10-3mol,由2KMnO4~5H2O2可知,n(H2O2)=VC×10-3mol×$\frac{5}{2}$=2.5VC×10-3mol,则原过氧化氢溶液中H2O2的质量分数为$\frac{2.5VC×1{0}^{-3}mol×34g/mol}{10ρ}$×100%=$\frac{17CV}{200ρ}$.
故答案为:$\frac{17CV}{200ρ}$.
点评 本题考查物质含量的测定及氧化还原反应,为高频考点,把握发生的反应及溶液配制、反应中物质的量关系为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度不大.

练习册系列答案
相关题目
15.同温同压下,已知O2的密度为ρg•L-1,则Cl2的密度为( )
| A. | $\frac{71ρ}{32}$g•L-1 | B. | $\frac{32ρ}{71}$g•L-1 | C. | $\frac{32}{71ρ}$g•L-1 | D. | $\frac{71}{32ρ}$g•L-1 |
12.关于铯及其化合物的以下各说法中不正确的是( )
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
19. 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且半分钟不恢复原色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D、E(填序号).
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
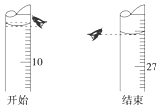
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如图所示.则起始读数为V1=9.00mL,终点读数V2=26.10mL.
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710mol•L-1.
 某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某同学欲用已知物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化.直到因加入一滴盐酸,溶液的颜色由红色变为无色,且半分钟不恢复原色,立即停止滴定.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是D、E(填序号).
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
(3)若第一次滴定开始和结束时,酸式滴定管中的液面如图所示.则起始读数为V1=9.00mL,终点读数V2=26.10mL.
(4)再结合表数据,计算被测氢氧化钠溶液的物质的量浓度是0.1710mol•L-1.
| 滴定 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | V1 | V2 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
9.下列各组物质中,不能按图示关系一步完成转化的是( )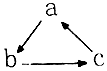

| A | B | C | D | |
| a | CO2 | Al(OH)3 | H2SO4 | HNO3 |
| b | Na2CO3 | NaAlO2 | SO2 | NO |
| c | NaHCO3 | Al2O3 | SO3 | NO2 |
| A. | A | B. | B | C. | C | D. | D |
13.下列分类或归类正确的是:①铝热剂、纯净矿泉水、冰水混合物均为混合物②NaOH、HD、IBr均为化合物③明矾、烧碱、硫酸均为强电解质④C60、金刚石、石墨均为碳的同素异形体⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体( )
| A. | ①③⑤ | B. | ③④ | C. | ②④⑤ | D. | ③④⑤ |
11.设NA为阿伏加德罗常数的值,下列叙述错误的是( )
| A. | 含14g硅原子的二氧化硅晶体中含有的硅氧键数目为2NA | |
| B. | 3.9g Na2O2晶体中含有0.2NA个离子 | |
| C. | 常温常压下,5g D2O含有的质子数、电子数、中子数均为2.5NA | |
| D. | 3mol H2和1molN2在一定条件下反应所得混合气体分子数大于2NA |
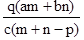 B.
B. 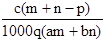 C.
C. 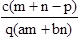 D.
D.