题目内容
写出下列溶液中离子浓度大小关系及三个守恒:
Na2CO3 、Na2S、CH3COOK、NaHCO3 、NH4Cl.
Na2CO3 、Na2S、CH3COOK、NaHCO3 、NH4Cl.
考点:离子浓度大小的比较
专题:
分析:任何电解质溶液中都存在电荷守恒、物料守恒和质子守恒,
①Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
②Na2S为强碱弱酸盐,S 2-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
③CH3COOK为强碱弱酸盐,CH3COO-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
④NaHCO3为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
⑤NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,根据电荷守恒判断离子浓度大小.
①Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
②Na2S为强碱弱酸盐,S 2-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
③CH3COOK为强碱弱酸盐,CH3COO-水解导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
④NaHCO3为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性,根据电荷守恒判断离子浓度大小;
⑤NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,根据电荷守恒判断离子浓度大小.
解答:
解:任何电解质溶液中都存在电荷守恒、物料守恒和质子守恒,
①Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CO32-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),存在质子守恒c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+);
②Na2S为强碱弱酸盐,S 2-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得 c(Na+)>c(S2-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),存在物料守恒c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),存在质子守恒c(OH-)=c(HS-)+2c(H2S)+c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-);c(Na+)=2c(S2-)+2c(HS-)+2c(H2S);c(OH-)=c(HS-)+2c(H2S)+c(H+);
③CH3COOK为强碱弱酸盐,CH3COO-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得
c(K+)>c(CH3COO-),水解程度较小,所以溶液中离子浓度大小顺序是c(K+)>c(CH3COO-)>c(OH-)>c(H+),
根据电荷守恒得c(K+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(K+)=c(CH3COO-)+c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COOH),
故答案为:c(K+)>c(CH3COO-)>c(OH-)>c(H+);c(K+)+c(H+)=c(CH3COO-)+c(OH-);c(K+)=c(CH3COO-)+c(CH3COOH);c(OH-)=c(H+)+c(CH3COOH);
④NaHCO3为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(HCO3-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在物料守恒c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),存在质子守恒c(H2CO3)+c(H+)=c(CO32-)+c(OH-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);c(H2CO3)+c(H+)=c(CO32-)+c(OH-);
⑤NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,即c(OH-)<c(H+),根据电荷守恒得
c(Cl-)>c(NH4+),所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),溶液中存在电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)、存在物料守恒c(Cl-)=c(NH4+)+c(NH3.H2O),所以得c(OH-)+c(NH3.H2O)=c(H+),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);c(OH-)+c(Cl-)=c(H+)+c(NH4+);c(Cl-)=c(NH4+)+c(NH3.H2O);c(OH-)+c(NH3.H2O)=c(H+).
①Na2CO3 为强碱弱酸盐,CO32-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(CO32-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CO32-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在物料守恒c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),存在质子守恒c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+),
故答案为:c(Na+)>c(CO32-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3);c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+);
②Na2S为强碱弱酸盐,S 2-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得 c(Na+)>c(S2-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),存在物料守恒c(Na+)=2c(S2-)+2c(HS-)+2c(H2S),存在质子守恒c(OH-)=c(HS-)+2c(H2S)+c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-);c(Na+)=2c(S2-)+2c(HS-)+2c(H2S);c(OH-)=c(HS-)+2c(H2S)+c(H+);
③CH3COOK为强碱弱酸盐,CH3COO-水解导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得
c(K+)>c(CH3COO-),水解程度较小,所以溶液中离子浓度大小顺序是c(K+)>c(CH3COO-)>c(OH-)>c(H+),
根据电荷守恒得c(K+)+c(H+)=c(CH3COO-)+c(OH-),根据物料守恒得c(K+)=c(CH3COO-)+c(CH3COOH),所以得c(OH-)=c(H+)+c(CH3COOH),
故答案为:c(K+)>c(CH3COO-)>c(OH-)>c(H+);c(K+)+c(H+)=c(CH3COO-)+c(OH-);c(K+)=c(CH3COO-)+c(CH3COOH);c(OH-)=c(H+)+c(CH3COOH);
④NaHCO3为强碱弱酸酸式盐,HCO3-水解程度大于电离程度导致溶液呈碱性,即c(OH-)>c(H+),根据电荷守恒得c(Na+)>c(HCO3-),水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(HCO3-)>c(OH-)>c(H+),
溶液中存在电荷守恒c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),存在物料守恒c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),存在质子守恒c(H2CO3)+c(H+)=c(CO32-)+c(OH-),
故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+);c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-);c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3);c(H2CO3)+c(H+)=c(CO32-)+c(OH-);
⑤NH4Cl为强酸弱碱盐,NH4+水解导致溶液呈酸性,即c(OH-)<c(H+),根据电荷守恒得
c(Cl-)>c(NH4+),所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),溶液中存在电荷守恒c(OH-)+c(Cl-)=c(H+)+c(NH4+)、存在物料守恒c(Cl-)=c(NH4+)+c(NH3.H2O),所以得c(OH-)+c(NH3.H2O)=c(H+),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);c(OH-)+c(Cl-)=c(H+)+c(NH4+);c(Cl-)=c(NH4+)+c(NH3.H2O);c(OH-)+c(NH3.H2O)=c(H+).
点评:本题离子浓度大小比较,明确物质的性质是解本题关键,知道任何电解质溶液中都存在原子守恒、电荷守恒及质子守恒,与溶液浓度、溶质的种类多少、电解质强弱无关,题目难度中等.

练习册系列答案
相关题目
下列各组物质的分类正确的是( )
①同位素:1H、2H2、3H
②同素异形体:C80、金刚石、石墨
③酸性氧化物:CO2、CO、SO3
④混合物:水玻璃、水银、水煤气
⑤电解质:明矾、冰醋酸、石膏
⑥干冰、液氯都是非电解质.
①同位素:1H、2H2、3H
②同素异形体:C80、金刚石、石墨
③酸性氧化物:CO2、CO、SO3
④混合物:水玻璃、水银、水煤气
⑤电解质:明矾、冰醋酸、石膏
⑥干冰、液氯都是非电解质.
| A、②⑤ | B、②⑤⑥ |
| C、②④⑤⑥ | D、①②③④⑤⑥ |
在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则参加反应的Cr3+与PbO2的个数之比为( )
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
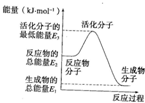 已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1
已知:①H2O(g)═H2O(l)△H2=-44kJ?mol-1②2H2(g)+O2(g)═2H2O(g)△H2=-483.6kJ?mol-1.
③N2(g)+3H2(g)═2NH3(g)△H2=-92.4kJ?mol-1
下列说法正确的是( )
| A、反应②中的能量变化如图所示,则△H2=E1-E3 |
| B、H2的燃烧热为△H=-241.8kJ?mol-1 |
| C、由反应③知在温度一定的条件下,在一恒容密闭容器中通入1molN2和3molH2,反应后放出的热量为92.4kJ |
| D、反应③中加入催化剂,通过降低反应所需的活化能来增大反应速率 |




 、
、 和
和 ,它们的物质的量之比为
,它们的物质的量之比为 (用反应流程图表示并注明反应条件)
(用反应流程图表示并注明反应条件)