题目内容
将碳酸钠和氯化钠的混合物12g,放入73g10%的盐酸中,恰好完全反应.求
(1)反应后溶液中溶质质量分数;
(2)取反应后溶液的一半,加入足量AgNO3溶液,生成沉淀多少克?
(1)反应后溶液中溶质质量分数;
(2)取反应后溶液的一半,加入足量AgNO3溶液,生成沉淀多少克?
考点:有关混合物反应的计算
专题:
分析:(1)发生反应:Na2CO3+2HCl=2NaCl+CO2↑+H2O,计算盐酸中HCl的质量,根据方程式计算碳酸钠的质量、生成氯化钠的质量、生成二氧化碳的质量,反应后溶液质量=12g+73g-m(CO2),计算原混合物中NaCl的质量,进而计算反应后溶液中NaCl总质量,计算溶液质量分数;
(2)计算反应后一半溶液中NaCl的质量,根据氯离子守恒n(AgCl)=n(NaCl),再根据m=nM计算AgCl的质量.
(2)计算反应后一半溶液中NaCl的质量,根据氯离子守恒n(AgCl)=n(NaCl),再根据m=nM计算AgCl的质量.
解答:
解:(1)73g10%的盐酸中HCl的质量为73g×10%=7.3g,则:
Na2CO3+2 HCl=2 NaCl+CO2↑+H2O
106 73 117 44
x 7.3g y z
x=
=10.6g
y=
=11.7g
z=
=4.4g
原混合物中NaCl质量为12g-10.6g=1.4g,
反应后NaCl总质量为11.7g+1.4g=13.1g
反应后溶液质量为12g+73g-4.4g=80.6g,
故反应后溶液质量分数为
×100%=16.25%,
答:反应后溶液中溶质质量分数为16.25%;
(2)反应后一半溶液中NaCl的质量为
=6.55g,根据氯离子守恒n(AgCl)=n(NaCl),故AgCl的质量为
×143.5g/mol=16.1g,
答:生成沉淀16.1克.
Na2CO3+2 HCl=2 NaCl+CO2↑+H2O
106 73 117 44
x 7.3g y z
x=
| 106×7.3g |
| 73 |
y=
| 117×7.3g |
| 73 |
z=
| 44×7.3g |
| 73 |
原混合物中NaCl质量为12g-10.6g=1.4g,
反应后NaCl总质量为11.7g+1.4g=13.1g
反应后溶液质量为12g+73g-4.4g=80.6g,
故反应后溶液质量分数为
| 13.1g |
| 80.6g |
答:反应后溶液中溶质质量分数为16.25%;
(2)反应后一半溶液中NaCl的质量为
| 13.1g |
| 2 |
| 6.55g |
| 58.5g/mol |
答:生成沉淀16.1克.
点评:本题考查混合物计算、化学方程式计算、质量分数计算等,难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
设NA表为阿伏加德罗常数的值,下列说法中正确的是( )
| A、4.6g钠与足量水反应,生成Na+离子的数目为0.2NA |
| B、标准状况下,4.48L水中含有H2O分子的数目为0.2NA |
| C、0.3mol 氯气中含有Cl原子的数目为0.3NA |
| D、0.2 mol/L CaCl2溶液中含有Clˉ离子的数目为0.4NA |
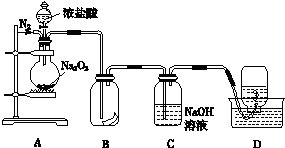
 某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na2O2)后气体呈红棕色,则下列推断正确的是( )
某无色气体可能由O2、CO、CO2、HCl、NH3、NO、Br2中的一种或几种组成,通过图中洗气瓶后气体体积减少(该装置前后都不与大气直接相连),通过干燥管(内盛放Na2O2)后气体呈红棕色,则下列推断正确的是( )| A、原气体中一定有NO和O2 |
| B、原气体中一定有NH3、NO、CO2、CO |
| C、原气体中一定没有CO |
| D、原气体中一定没有HCl、Br2、O2 |
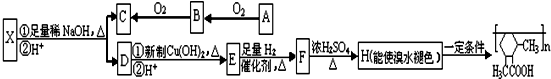

 如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )
如图所示,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管胶头,使液体Y滴入瓶中,振荡,一会儿可见小气球a鼓起.气体X和液体Y不可能是( )