题目内容
15. 氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0
氨是一种重要的化工原料,氨的合成和应用仍是当前的重要研究内容之一.化学方程式为N2(g)+3H2(g)?2NH3(g)△H<0(1)升高温度,正反应速率(V正)增大(填“增大”、“减小”或“不变”),化学平衡逆向(正向或逆向)移动.
(2)温度为T℃时,将5a mol H2和2a mol N2放入0.5L密闭容器中,10分钟后反应达到平衡,测得N2的转化率为50%,则以H2表示的反应速率为0.6amol/(L•min);反应的平衡常数为$\frac{1}{{8{a^2}}}$
(3)一定条件下,下列叙述可以说明该反应已达平衡状态的是C
A.υ正(N2)=υ逆(NH3)
B.各物质的物质的量相等
C.混合气体的物质的量不再变化
D.混合气体的密度不再变化
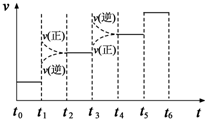
(4)图表示合成氨反应在某一时间段中反应速率υ与反应过程时间t的关系图.由图判断,NH3的百分含量最高的一段时间是t2~t3;图中t3时改变的条件可能是C.
A.加了催化剂 B.扩大容器的体积 C.升高温度 D.增大压强.
分析 (1)升高温度,正逆反应速率都加快,化学平衡向吸热反应方向移动;
(2)应用三行式,根据反应速率v=$\frac{△c}{△t}$,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,进行计算求解;
(3)根据达平衡状态的实质和特征分析解答;
(4)t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2-t3;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,引起平衡移动的条件可能是升高温度.
解答 解:(1)升高温度,正反应速率增大,化学平衡逆向移动,故答案为:增大;逆向;
(2)N2(g)+3H2(g)?2NH2(g)
开始 4amol/L 10amol/L 0
反应 2amol/L 6amol/L 4amol/L
平衡 2amol/L 4amol/L 4amol/L
所以v(H2)=$\frac{△c}{△t}$=$\frac{6amol/L}{10min}$=0.6mol/(L•min),
化学平衡常数K=$\frac{(4amol/L)^{2}}{(2amol/L)×(4amol/L)^{3}}$=$\frac{1}{{8{a^2}}}$(L/mol)2,
故答案为:0.6a mol/(L•min);$\frac{1}{{8{a^2}}}$(L/mol)2;
(3)A.υ正(N2)=υ逆(NH3),速率之比不等于化学计量数之比,故A错误;
B.各物质的物质的量相等,而不是不变的状态,故B错误;
C.混合气体的物质的量不再变化,说明各组分的物质的量不变,反应达平衡状态,故C正确;
D.混合气体的密度一直不随时间的变化而变化,故D错误;
故选C;
(4)t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2-t3;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,引起平衡移动的条件可能是升高温度,
故答案为:t2~t3;C.
点评 本题考查了影响化学反应速率的因素、图象分析,化学平衡三段式计算等知识点,注意知识的迁移和应用是关键,难度不大.

| A. | 该元素原子的最外层电子数 | |
| B. | 化合时该元素的一个原子得到的电子数 | |
| C. | 该元素一个原子结合其他元素原子的个数 | |
| D. | 该元素一个原子与其他原子形成共用电子对的数目 |
| A. | 醋酸中的c(CH3COO-)和硫酸中的c(SO42-)相等 | |
| B. | 分别加水稀释100倍后,硫酸溶液的pH变化比醋酸溶液小 | |
| C. | 两种溶液中,由水电离出的c(H+)=1×10-11mol•L-1 | |
| D. | 分别加入足量铁片充分反应后,两溶液中产生的氢气一样多 |
| A. | ${\;}_y^m$X | B. | ${\;}_y^{y+m}$X | C. | ${\;}_{y+n}^{m+y-n}$X | D. | ${\;}_{y+n}^{m+y+n}$X |
| A. | 与水反应可生成酸的氧化物都是酸性氧化物 | |
| B. | 既能与酸反应又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| C. | 晶体的熔化、水的汽化和液化、KMnO4溶液的酸化以及煤的气化和液化均属物理变化 | |
| D. | 有单质参加的反应或有单质生成的反应不一定是氧化还原反应 |
| A. | 试管 | B. | 烧杯 | C. | 锥形瓶 | D. | 蒸馏烧瓶 |
| A. | 是纯净物 | B. | 所得物质一定为悬浊液或乳浊液 | ||
| C. | 能通过过滤的方法得到纳米材料 | D. | 有丁达尔现象 |