题目内容
用NA表示阿伏加德罗常数的值,下列说法错误的是( )
| A、常温常压下11.2L的甲烷气体含有甲烷分子数为0.5NA个 |
| B、24gMg变为Mg2+时失去的电子数为2NA |
| C、32gO2和O3混合气体中含有氧原子的个数为2NA |
| D、1L1mol/LNaCl溶液中含有钠离子的个数为NA |
考点:阿伏加德罗常数
专题:
分析:A.常温下,Vm≠22.4L/mol;
B.1个镁原子失去2个电子变为Mg2+;
C.根据臭氧的分子式计算原子数;
D.1L1mol/L氯化钠溶液中含有的钠离子物质的量为1mol.
B.1个镁原子失去2个电子变为Mg2+;
C.根据臭氧的分子式计算原子数;
D.1L1mol/L氯化钠溶液中含有的钠离子物质的量为1mol.
解答:
解:A.常温下,Vm≠22.4L/mol,11.2L的物质的量不是0.5mol,故A错误;
B.镁原子最外层电子数为2,1个镁原子失去2个电子变为Mg2+,24克金属镁物质的量为1mol,失去电子物质的量为0.2mol,即2NA,故B正确;
C.32gO2和O3混合气体中含有氧原子的质量是32g,含有氧原子物质的量:n=
=2mol,含有氧原子的个数为2NA,故C正确;
D.1L1mol/L氯化钠溶液中含有的钠离子物质的量为1mol,个数为NA,故D正确.
故选A.
B.镁原子最外层电子数为2,1个镁原子失去2个电子变为Mg2+,24克金属镁物质的量为1mol,失去电子物质的量为0.2mol,即2NA,故B正确;
C.32gO2和O3混合气体中含有氧原子的质量是32g,含有氧原子物质的量:n=
| 32g |
| 16g/mol |
D.1L1mol/L氯化钠溶液中含有的钠离子物质的量为1mol,个数为NA,故D正确.
故选A.
点评:本题考查阿伏加德罗常数的相关计算,题目难度不大,注意物质的组成、结构、性质以及物质存在的外界条件和聚集状态等问题.

练习册系列答案
相关题目
下列说法正确的是( )
| A、在CuSO4溶液中加入PbS,可转变为铜蓝(CuS),则Ksp(PbS)<Ksp(CuS) |
| B、在NaHS溶液中,加入少量CuCl2粉末产生黑色沉淀,则pH增大 |
| C、加热条件下并加入大量水促进TiCl4水解,以制备TiO2固体 |
| D、铜制器皿放置过程中会生成铜绿是因为发生了析氢腐蚀 |
下列化肥在空气中放置一段时间后,肥效降低的是( )
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
①氨水 ②硫酸铵 ③碳酸氢铵 ④氯化钾 ⑤尿素.
| A、①② | B、①③ | C、③④ | D、②⑤ |
下列有关实验室制取气体的反应中,其原理不属于氧化还原反应的是( )
| A、实验室中用稀硫酸与锌粒反应制取H2 |
| B、实验室中用高锰酸钾加热分解制取O2 |
| C、实验室中用浓盐酸与二氧化锰加热制取Cl2 |
| D、实验室中用稀盐酸与石灰石反应制取CO2 |
设NA代表阿伏加德罗常数,下列说法正确的是( )
| A、73g氯化氢溶于水中,所含氯化氢分子数为2NA |
| B、标准状况下,18g水所含的原子数目为NA |
| C、标准状况下,22.4L氮气所含的原子数目为NA |
| D、常温常压下,2.8gCO和N2混合气体所含原子数为0.2NA |
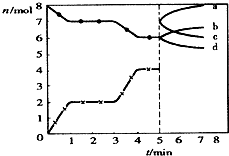 炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )
炼铁的还原剂CO是由焦炭和CO2反应而得.现将焦炭和CO2放入体积为2L的密闭容器中,高温下进行下列反应:C(s)+CO2(g)?2CO(g)△H=QkJ/mol.如图为CO2、CO的物质的量n随时间t的变化关系图.下列说法正确的是( )A、0~lmin,v(CO)=1mol/(L?min);1~3min时,v(CO)=v(CO2);该反应的平衡常数表达式为k=
| ||
B、当容器内的压强不变时,该反应一定达到平衡状态,且
| ||
C、3min时温度由T1升高到T2,则Q>O,重新平衡时
| ||
| D、5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
在体积相同的两个密闭容器中分别充满O2、O3气体,当这两个容器在相同的温度和压强下时,下列说法正确的是( )
| A、两种气体的质量相等 |
| B、两容器中气体的密度相等 |
| C、两种气体的分子数目相等 |
| D、两种气体的氧原子数目相等 |
下列溶液中Cl-浓度最大的是( )
| A、20mL2mol/LMgCl2溶液 |
| B、10mL2.5mol/LNaCl溶液 |
| C、25mL1mol/LAlCl3溶液 |
| D、30mL10mol/LKClO3溶液 |
 随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题:
随着生活水平的提高,人们越来越关注自身的健康.以下是探讨化学物质与人体健康的有关问题: