题目内容
氨气和氯气接触会产生白烟(NH4Cl),利用这一反应,化工厂的工人可用沾有浓氨水的玻璃棒检验输送氨气的管道是否漏气,该反应的化学方程式为8NH3+3Cl2═6NH4Cl+N2.请回答下列问题:
(1)该反应的氧化剂是 ,反应中被还原的物质是 .
(2)该反应的氧化剂与还原剂的物质的量之比为 ,质量之比 .
(3)若反应中生成14g N2,则参加反应的氨气在标准状况下的体积是 ,反应中转移的电子数目是 .
(1)该反应的氧化剂是
(2)该反应的氧化剂与还原剂的物质的量之比为
(3)若反应中生成14g N2,则参加反应的氨气在标准状况下的体积是
考点:氧化还原反应的计算,氧化还原反应
专题:
分析:该反应中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,
(1)得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂被还原;
(2)该反应中有
的氨气被氧化,氧化剂和还原剂的物质的量之比为3:2,根据m=nM计算其质量之比;
(3)14g氮气的物质的量=
=0.5mol,根据方程式知8n(N2)=n(NH3)=4mol,根据V(NH3)=nVm计算氨气体积,根据氮气和转移电子之间的关系式计算转移电子数目.
(1)得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂被还原;
(2)该反应中有
| 1 |
| 4 |
(3)14g氮气的物质的量=
| 14g |
| 28g/mol |
解答:
解:该反应中部分N元素化合价由-3价变为0价、Cl元素化合价由0价变为-1价,
(1)根据元素化合价变化知,氧化剂是Cl2,氧化剂被还原,所以被还原的物质是Cl2,故答案为:Cl2;Cl2;
(2)该反应中有
的氨气被氧化,氧化剂和还原剂的物质的量之比为3:2,假设有3mol氯气参加反应,则有2mol氨气参加氧化反应,3mol氯气质量=3mol×71g/mol=213g,2mol氨气质量=2mol×17g/mol=34g,则氧化剂和还原剂的质量之比=213g:34g=213:34,
故答案为:3:2;213:34;
(3)14g氮气的物质的量=
=0.5mol,根据方程式知8n(N2)=n(NH3)=0.5mol×8=4mol,氨气体积V(NH3)=nVm=4mol×22.4L/mol=89.6L,转移电子物质的量=0.5mol×2[0-(-3)]=3mol,则转移电子数为3NA,
故答案为:89.6L;3NA.
(1)根据元素化合价变化知,氧化剂是Cl2,氧化剂被还原,所以被还原的物质是Cl2,故答案为:Cl2;Cl2;
(2)该反应中有
| 1 |
| 4 |
故答案为:3:2;213:34;
(3)14g氮气的物质的量=
| 14g |
| 28g/mol |
故答案为:89.6L;3NA.
点评:本题考查氧化还原反应,明确反应中各个物理量的关系是解本题关键,熟练运用物质的量公式进行计算,注意该反应中部分氨气作还原剂,题目难度不大.

练习册系列答案
相关题目
第112号元素已被正式命名为Copernicium(中文译名:鎶),符号:Cn.下列关于
Cn的说法中正确的是( )
276 112 |
| A、质量数为388 |
| B、中子数为276 |
| C、质子数为164 |
| D、电子数为112 |
分子式为C5H10O3的有机物,在一定条件下能发生如下反应:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在特定温度及浓硫酸存在下,能生成一种能使溴水褪色的物质;③在特定温度及浓硫酸存在下,还能生成一种分子式为C5H8O2的五元环状化合物.则C5H10O3的结构简式为( )
| A、HOCH2CH2COOCH2CH3 |
| B、HOCH2CH2CH2CH2COOH |
| C、CH3CH2CH(OH)CH2COOH |
| D、CH3CH(OH)CH2CH2COOH |
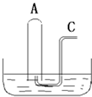 如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.
如图所示:在B槽中装有500mL水,容积为a mL的试管A充满了NO2和NO的混合气体(标准状况),将试管A倒插入B槽的水中,充分反应,试管A中余下气体的体积为0.5amL.