题目内容
13.将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.如图是石膏转化为硫酸钾和氯化钙的工艺流程示意图: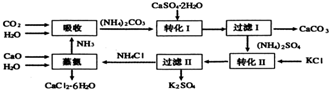
(1)本工艺中所用的原料除CaSO4•2H2O、CaCO3、H2O外,还需要的两种原料是NH3、KCl;写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程CaSO4+CO32-=CaCO3↓+SO42-.
(2)过滤I操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的操作方法是取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之,则不含有CO32-.
(3)过滤I的滤液中的Ca2+浓度低于1.0×10-5mol•L-1时可认为被沉淀完全.若要使Ca2+沉淀完全,则滤液中c(CO32-)大于5.0×10-4mol/L.[已知:该温度下Ksp(CaCO3)=5.0×10-9]
(4)写出“蒸氨”过程中的化学方程式:CaO+NH4Cl+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2.6H2O+2NH3↑.
(5)生产医用二水合氯化钙(CaCl2•2H2O)蒸发结晶要保持在160℃的原因是温度过高时CaCl2.2H2O会失去结晶水.氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad(填字母).
a.熔点29℃较低 b.能导电 c.能制冷 d.无毒.
分析 流程图分析:吸收环节NH3、CO2、H2O生成碳酸铵,碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离,(NH4)2SO4和KCl的饱和溶液中,由于溶解度不同析出K2SO4晶体,过滤分离得到NH4Cl和K2SO4,蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)由上述分析可知,原料除CaSO4.2H2O、CaCO3、H2O外,还需要的两种原料是氨气与氯化钾;
碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4;
(2)利用CO32-与酸反应生成二氧化碳进行检验;
(3)根据Ksp(CaCO3)=c(Ca2+)×c(CO32-)计算;
(4)蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3;
(5)温度过高时CaCl2.2H2O会失去结晶水;氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低易熔化,且无毒,与能制冷,能导电无关.
解答 解:由流程图可知,吸收环节NH3、CO2、H2O生成碳酸铵,碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,经过滤后分离,(NH4)2SO4和KCl的饱和溶液中,由于溶解度不同析出K2SO4晶体,过滤分离得到NH4Cl和K2SO4,蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3.
(1)由上述分析可知,原料除CaSO4.2H2O、CaCO3、H2O外,还需要的两种原料是NH3与KCl;
碳酸铵和石膏悬浊液反应生成CaCO3、(NH4)2SO4,反应离子方程式为:CaSO4+CO32-=CaCO3↓+SO42-,
故答案为:NH3;KCl;CaSO4+CO32-=CaCO3↓+SO42-;
(2)利用CO32-与酸反应生成二氧化碳进行检验,具体操作为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之,则不含有CO32-,
故答案为:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之,则不含有CO32-;
(3)Ca2+浓度低于1.0×10-5mol•L-1 时可认为被沉淀完全,若要使Ca2+沉淀完全,根据Ksp(CaCO3)=c(Ca2+)×c(CO32-),可知溶液中c(CO32-)>$\frac{5.0×1{0}^{-9}}{1.0×1{0}^{-5}}$mol/L=5.0×10-4mol/L,
故答案为:5.0×10-4mol/L;
(4)蒸氨环节的为CaO、H2O、NH4Cl生成为CaCl2.6H2O和NH3,反应方程式为:CaO+NH4Cl+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2.6H2O+2NH3↑,
故答案为:CaO+NH4Cl+5H2O$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2.6H2O+2NH3↑;
(5)温度过高时CaCl2.2H2O会失去结晶水,蒸发结晶要保持在160℃;氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,是因为氯化钙结晶水合物熔点低,吸收热量易熔化,且无毒,与能制冷,能导电无关,
故答案为:温度过高时CaCl2.2H2O会失去结晶水;ad.
点评 本题考查物质的制备方案、混合物分离提纯的综合应用.溶度积有关计算等,关键是理解工艺流程原理,侧重反应原理的分析及应用,题目难度中等.

 教材全解字词句篇系列答案
教材全解字词句篇系列答案| A. | 4、3、5 | B. | 4、3、6 | C. | 2、5、4 | D. | 4、4、6 |
(1)NH3催化还原NxOy可以消除氮氧化物的污染,包含以下反应:
反应Ⅰ:4NH3(g)+6NO(g)?5N2(g)+6H2O(l)△H1
反应Ⅱ:2NO(g)+O2(g)?2NO2(g)△H2
反应Ⅲ:4NH3(g)+6NO2(g)?5N2(g)+3O2(g)+6H2O(l)△H3
则△H3=△H1-3△H2(用△H1和△H2的代数式表示).n(N2)(mol)
相同条件下,反应I在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图1所示.
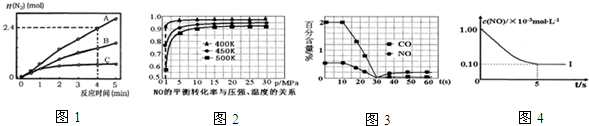
①计算0~4min在A催化剂作用下,反应速率v(NO)=0.36mol•L-1•min-1.
②下列说法不正确的是a.
a.该反应的活化能大小顺序是:Ea(A)>Eb(B)>Ec(C)
b.缩小体积能使体系压强增大,反应速率加快,但活化分子的百分数不变
c.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)三元催化转化装置是安装在汽车排气系统中最重要的机外净化装置,装置中涉及的反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g).
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图2所示的曲线.催化装置比较适合的温度和压强是400K,1MPa.
②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图3所示.则前10s内,CO和NO百分含量没明显变化的原因是尚未达到催化剂工作温度(或尚未达到反应的温度).
| 实验编号 | T(K) | NO初始浓度 (mol•L-1) | CO初始浓度 (mol•L-1) | 催化剂的比表面积(m2/g) |
| Ⅰ | 400 | 1.00×10-3 | 3.60×10-3 | 82 |
| Ⅱ | 400 | 1.00×10-3 | 3.60×10-3 | 124 |
| Ⅲ | 450 | 1.00×10-3 | 3.60×10-3 | 124 |
根据坐标图4,计算400K时该反应的平衡常数为5000L•mol-1;并在图中画出上表中的实验II、III条件下混合气体中NO浓度随时间变化的趋势曲线图(标明各条曲线的实验编号).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH4O | CH2O | CH2O2 | C2H6 | C2H6O | C2H4O | C2H4O2 |
| A. | ①③④ | B. | ②④⑤ | C. | ②③④ | D. | ②③⑤ |
| T(℃) | 527 | 627 | 727 | 827 | 927 |
| 平衡常数K | 910 | 42 | 3.2 | 0.39 | 0.12 |
| A. | 根据平衡常数随温度的变化关系,判断出△H<0 | |
| B. | 保持其他条件不变,SO2的平衡转化率α(727℃)<α(927℃) | |
| C. | 增大压强、降低温度能提高SO2的转化率 | |
| D. | SO3的稳定性随温度的升高而降低 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 生成的气体是NH3 |
| B | 向AgI悬浊液中加入NaCl细粒 | 一定不出现白色沉淀 | 更难溶的物质无法转化为难溶的物质 |
| C | 某实验小组从资料上获得信息:Fe3+可以氧化银单质.他们用这种方法清洗了一批做了银镜反应的试管.配制了Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别用于清洗试管. | 用FeCl3溶液清洗比用Fe2(SO4)3溶液清洗得干净 | Fe3+氧化银单质的过程可能是一个可逆过程: Fe3++Ag?Fe2++Ag+ |
| D | 向某溶液中滴加氯水后再加入KSCN溶液 | 溶液呈红色 | 溶液中一定含有Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 60g丙醇中存在的共价键总数为11NA | |
| B. | 0.5 mol•L-1 CuCl2溶液中含有的Cl-个数为NA | |
| C. | 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA | |
| D. | 在反应4Cl2+8NaOH═6NaCl+NaClO+NaClO3+4H2O中,消耗1mol Cl2时转移的电子总数为1.5NA |
 .
.