题目内容
下列物质性质的比较叙述正确的是( )
| A、在水中溶解性:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、同浓度溶液与足量酸反应的速度:Na2CO3>NaHCO3 |
| D、将固体溶于少量水放出的热量:Na2CO3<NaHCO3 |
考点:探究碳酸钠与碳酸氢钠的性质
专题:几种重要的金属及其化合物
分析:A.可溶性碳酸盐的溶解性大于碳酸氢盐,难溶性碳酸盐的溶解性小于碳酸氢盐;
B.NaHCO3不稳定受热易分解,Na2CO3较稳定;
C.Na2CO3和稀盐酸反应先生成NaHCO3,NaHCO3再和稀盐酸反应生成二氧化碳;
D.Na2CO3、NaHCO3溶于水都放出热量,但碳酸钠放出的热量较多.
B.NaHCO3不稳定受热易分解,Na2CO3较稳定;
C.Na2CO3和稀盐酸反应先生成NaHCO3,NaHCO3再和稀盐酸反应生成二氧化碳;
D.Na2CO3、NaHCO3溶于水都放出热量,但碳酸钠放出的热量较多.
解答:
解:A.可溶性碳酸盐的溶解性大于碳酸氢盐,难溶性碳酸盐的溶解性小于碳酸氢盐,碳酸钠是可溶性盐,所以在水中溶解性:Na2CO3>NaHCO3,故A错误;
B.NaHCO3不稳定受热易分解,发生反应2NaHCO3
Na2CO3+CO2↑+H2O,Na2CO3较稳定,所以热稳定性:Na2CO3>NaHCO3,故B正确;
C.Na2CO3和稀盐酸反应先生成NaHCO3,NaHCO3再和稀盐酸反应生成二氧化碳,所以同浓度溶液与足量酸反应的速度:Na2CO3<NaHCO3,故C错误;
D.Na2CO3、NaHCO3溶于水都放出热量,在水中溶解性:Na2CO3>NaHCO3,导致碳酸钠放出的热量较多,故D错误;
故选B.
B.NaHCO3不稳定受热易分解,发生反应2NaHCO3
| ||
C.Na2CO3和稀盐酸反应先生成NaHCO3,NaHCO3再和稀盐酸反应生成二氧化碳,所以同浓度溶液与足量酸反应的速度:Na2CO3<NaHCO3,故C错误;
D.Na2CO3、NaHCO3溶于水都放出热量,在水中溶解性:Na2CO3>NaHCO3,导致碳酸钠放出的热量较多,故D错误;
故选B.
点评:本题考查Na2CO3、NaHCO3的性质,涉及溶解性、热稳定性、与酸反应速率,知道碳酸盐、碳酸氢盐溶解性相对强弱规律,注意碳酸钠和稀盐酸反应先后顺序,为常考查点.

练习册系列答案
相关题目
某种混合气体,可能含有N2、HCl和CO,把混合气体依次通过足量的NaHCO3溶液和灼热的CuO,气体体积都没有变化,经干燥后再通过足量的Na2O2固体,气体体积减少,最后通过灼热的铜网,经充分反应后,气体体积又减少,但还有剩余气体,以下对混合气体区分的判断,正确的是( )
| A、一定没有N2,CO和HCl中至少有一种 |
| B、一定没有N2,CO和HCl都有 |
| C、一定有N2,CO和HCl中至少有一种 |
| D、一定有N2和HCl,肯定没有CO |
往下列溶液中,通入足量CO2气体,最终能产生白色沉淀的是( )
| A、饱和Na2CO3溶液 |
| B、澄清石灰水 |
| C、CaCl2溶液 |
| D、盐酸 |
某透明的溶液中加入铝粉能放出氢气,此溶液中一定能大量共存的离子组是( )
| A、K+、Cu2+、Cl-、SO42- |
| B、HCO3-、NO3-、SO42-、Na+ |
| C、Cl-、SO42-、K+、Na+ |
| D、Na+、SO42-、Cl-、AlO2- |
向一定量的Fe、FeO、Fe2O3的混合物中加入100mL浓度为1.0mol?L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无血红色出现.若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是( )
| A、11.2g | B、5.6g |
| C、2.8g | D、1.4g |
下列实验操作及结论都正确的是( )
| A、制取氢氧化铁胶体,可向沸水中加入FeCl3溶液 |
| B、加热蒸发NaHCO3溶液,最终可获得NaOH固体 |
| C、向醋酸溶液中加入固体的醋酸钠,可增大醋酸的电离度 |
| D、配制SnCl2溶液时,可加入过量的硫酸,抑制水解 |

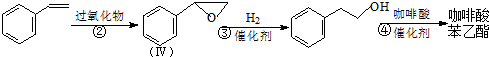
 的芳香化合物共有5种
的芳香化合物共有5种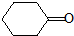 )与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为
)与化合物Ⅱ也能发生反应①的反应,则其生成含羧基的化合物的结构简式为