题目内容
18.某化学兴趣小组以黄铁矿(主要成分为FeS2)为原料进行如下实验探究.为测定黄铁矿中硫元素的质量分数,将m1g该黄铁矿样品放入如图1所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品.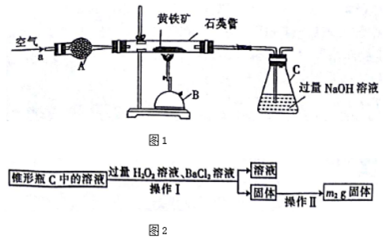
(1)仪器B的名称是酒精喷灯.
(2)仪器A的作用是干燥空气,锥形瓶C中NaOH溶液的作用是吸收生成的SO2,防止其污染空气.
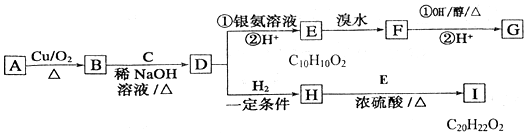
(3)反应结束后将锥形瓶C中的溶液进行如如2处理:
①操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法为将固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2~3次.
②上述流程中生成固体反应的离子方程式为SO32-+H2O2+Ba2+=BaSO4↓+H2O.
③经过分析,向m2g固体中加入过量稀盐酸时,无明显现象,则该黄铁矿中硫元素的质量分数为$\frac{32{m}_{2}}{233{m}_{1}}$×100%(用含m1、m2的代数式表示).
分析 测定黄铁矿中硫元素的质量分数,黄铁矿(主要成分为FeS2)与空气在高温条件下反应,由氢氧化钠吸收生成的二氧化硫气体,为防止空气中二氧化碳的干扰,仪器A用碱石灰干燥空气,得到亚硫酸钠溶液,与过氧化氢反应,被氧化为硫酸根离子,再与氯化钡生成沉淀,根据沉淀硫酸钡的质量,由元素质量守恒计算硫元素的质量分数,据此分析作答.
解答 解:(1)仪器B为酒精喷灯;
故答案为:酒精喷灯;
(2)为防止空气中二氧化碳的干扰,仪器A用碱石灰干燥空气;由氢氧化钠吸收生成的二氧化硫气体,防止其污染空气;
故答案为:干燥空气;吸收生成的SO2,防止其污染空气;
(3)①洗涤的方法为:将固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2~3次;
故答案为:将固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待滤液自然流下后,重复上述操作2~3次;
②上述流程中生成固体反应为亚硫酸被过氧化氢氧化为硫酸根离子,再与氯化钡生成沉淀,离子方程式为:SO32-+H2O2+Ba2+=BaSO4↓+H2O;
故答案为:SO32-+H2O2+Ba2+=BaSO4↓+H2O;
③得到沉淀质量为m2g为硫酸钡的质量,物质的量=$\frac{{m}_{2}}{233}$mol;
根据硫元素守恒,则黄铁矿中硫元素的质量分数=$\frac{\frac{{m}_{2}}{233}×32}{{m}_{1}}$×100%=$\frac{32{m}_{2}}{233{m}_{1}}$×100%;
故答案为:$\frac{32{m}_{2}}{233{m}_{1}}$×100%.
点评 本题考查了探究物质的含量实验,根据元素化合物的性质来分析解答即可,难度不大,注意为防止空气中二氧化碳的干扰,通入石英管中的空气要先除去二氧化碳过程计算式关键.

| A. | Ag+、Cu2+、Sb3+ | B. | Cu2+、Ag+、Sb3+ | C. | Sb3+、Ag+、Cu2+ | D. | Ag+、Sb3+、Cu2+ |
| A. | 标准状况下,224 mL水中含有的电子数为0.1NA | |
| B. | 44 g由N2O和CO2组成的混合气体中含有的原子数为3NA | |
| C. | 将20 mL 0.5 mol•L-1 FeCl3溶液煮沸,所得胶粒数目为0.01NA | |
| D. | 在反应:KClO3+6HCl═KCl+3Cl2+3H2O中,每生成3mol Cl2,转移的电子数为6NA |
| A. | 1L 0.1mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 4.6g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子 | |
| C. | 标准状况下,将22.4L Cl2通入水中发生反应,转移的电子数为NA | |
| D. | 100g 46%的乙醇溶液中,含H-O键的数目为NA |
| A. | 在厨房里用米汤不能直接检验食盐中是否含有碘 | |
| B. | 煤炭经过干馏,可获得相对清洁的能源和重要的化工原料 | |
| C. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| D. | 水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 |
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
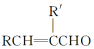 +H2O
+H2O ;E中含氧官能团的名称:羧基.
;E中含氧官能团的名称:羧基. +
+ $→_{加热}^{浓硫酸}$
$→_{加热}^{浓硫酸}$ +H2O.
+H2O.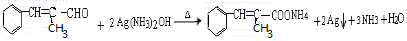 .
. .
.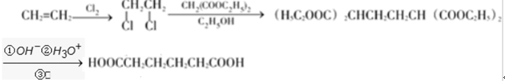 .
. 氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.
氢气是一种十分熟悉的物质.在许多反应中既可以作为反应物,也可以作物生成物.