题目内容
 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是
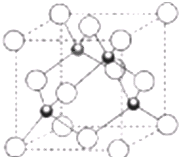
(4)元素W的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是
考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,
再结合物质结构分析解答.
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,
再结合物质结构分析解答.
解答:
解:原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,则X是H元素;
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,
(1)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,故答案为:sp;3NA;
(2)氨气中存在氢键,甲烷中不存在氢键,氢键的存在导致氨气的沸点升高,所以化合物NH3的沸点比化合物CH4的高,故答案为:氨气中存在氢键、甲烷中不存在氢键;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,故答案为:N2O;
(4)该晶胞中黑色球个数=4,白色球个数=8×
+6×
=4,所以黑色球和白色球个数之比=4:4=1:1,所以该氯化物的化学式为CuCl,故答案为:CuCl.
Y原子基态时最外层电子数是其内层电子数的2倍,原子最外层电子数不超过8个,所以其内层为K层,则Y是C元素;
Z原子基态时2p原子轨道上有3个未成对的电子,则Z是N元素;
W的原子序数为29,则W是Cu元素,
(1)C2H2分子中每个C原子含有2个σ键,所以C轨道的杂化类型为sp杂化,一个乙炔分子中含有3个σ键,则1mol C2H2含有σ键的数目为3NA,故答案为:sp;3NA;
(2)氨气中存在氢键,甲烷中不存在氢键,氢键的存在导致氨气的沸点升高,所以化合物NH3的沸点比化合物CH4的高,故答案为:氨气中存在氢键、甲烷中不存在氢键;
(3)元素C的一种氧化物与元素N的一种氧化物互为等电子体,CO2和N2O互为等电子体,所以元素Z的这种氧化物的分子式是N2O,故答案为:N2O;
(4)该晶胞中黑色球个数=4,白色球个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题考查了元素位置结构性质的相互关系及应用,涉及晶胞的计算、氢键、原子杂化方式的判断等知识点,这些知识点都是考试热点,灵活运用基本知识来分析解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列的离子方程式正确的是( )
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、向氢氧化钡溶液中加硫酸溶液:SO42-+Ba2+=BaSO4↓ |
| C、硫酸溶液中加入Mg(OH)2:2H++Mg(OH)2═Mg2++2H2O |
| D、铁与稀盐酸反应:Fe+6H+═2Fe3++3H2↑ |
常温下0.1mol?L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是( )
①将溶液稀释到原体积的10倍 ②升温 ③加锌粒 ④加入适量的NaOH固体 ⑤加Na2SO4溶液
⑥加入适量的醋酸钠固体 ⑦加NaHSO3 固体 ⑧加入等体积0.2mol?L-1盐酸.
①将溶液稀释到原体积的10倍 ②升温 ③加锌粒 ④加入适量的NaOH固体 ⑤加Na2SO4溶液
⑥加入适量的醋酸钠固体 ⑦加NaHSO3 固体 ⑧加入等体积0.2mol?L-1盐酸.
| A、①②④⑧ | B、③④⑤⑥ |
| C、③④⑥⑧ | D、①④⑤⑥⑦ |
下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②CH3CH2CH═CH2 ③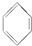 ④CH3CH3.
④CH3CH3.
①SO2 ②CH3CH2CH═CH2 ③
 ④CH3CH3.
④CH3CH3.| A、①②③④ | B、③④ |
| C、①②④ | D、①② |
 下表是长式周期表的一部分,其中的编号代表对应的元素.
下表是长式周期表的一部分,其中的编号代表对应的元素.