题目内容
(1)取一定量的铁粉与2mol?L-1稀硝酸400mL反应,反应后硝酸和铁均无剩余(铁只显+2价),且硝酸的还原产物只有NO.(不考虑溶液体积的变化)
①若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、H+、NO3ˉ 三种离子中的某离子的物质的量的变化曲线如下图(1)所示,则该曲线表示的是 物质的量变化.
②若下图(1)中,当反应消耗0.2mol铁时,所需时间为2分钟,则H+离子的反应速率为 .

(2)0.10mol?L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
①在图(2)中a表示向稀醋酸中不断加水,b表示向稀醋酸中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液.a中醋酸电离百分率的变化图线已画出,请你在上左图(1)中画出b过程中醋酸电离百分率的变化图线.
②一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
求该温度下醋酸的电离常数 .当醋酸浓度为0.1mol?L-1时,则电离百分率为 .
(3)乙醇是一种可再生能源,可用它来制成燃料电池(如上图3),试写出其负极的电极反应式 .现用该燃料电池为电源,实现在铁片上镀铜,应将 与铁片相连,当铁片上镀上19.2g铜时,消耗的乙醇为 克.
①若将铁粉慢慢加入到稀硝酸中,并搅拌,反应过程中溶液里Fe3+、H+、NO3ˉ 三种离子中的某离子的物质的量的变化曲线如下图(1)所示,则该曲线表示的是
②若下图(1)中,当反应消耗0.2mol铁时,所需时间为2分钟,则H+离子的反应速率为

(2)0.10mol?L-1的稀醋酸中存在着平衡:CH3COOH?CH3COOˉ+H+.
①在图(2)中a表示向稀醋酸中不断加水,b表示向稀醋酸中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液.a中醋酸电离百分率的变化图线已画出,请你在上左图(1)中画出b过程中醋酸电离百分率的变化图线.
②一定温度下,利用pH计测定不同浓度醋酸溶液的pH值,得到如下数据:
| 醋酸浓度(mol?L-1) | 1 | 0.1 | 0.01 |
| pH值 | 2.50 | 3.00 | 3.50 |
(3)乙醇是一种可再生能源,可用它来制成燃料电池(如上图3),试写出其负极的电极反应式
考点:弱电解质在水溶液中的电离平衡,离子方程式的有关计算,原电池和电解池的工作原理
专题:
分析:(1)①最初NO3-为0.8mol,故图中曲线表示NO3-物质的量的变化;
②当反应消耗0.2mol铁时,发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,据v(H+)=
分析计算;
(2)①向0.1mol/L的醋酸溶液中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液时,能够中和氢离子,平衡正向移动,醋酸的电离百分数增大;
②0.1mol/L的醋酸溶液的pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,据Ka=
计算;根据溶液pH和醋酸浓度计算电离度;
(3)原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子;在铁片上镀铜时,铁片做阴极,接电源的负极,生成19.2g铜时,转移电子0.6mol,据电子守恒计算消耗乙醇的质量.
②当反应消耗0.2mol铁时,发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,据v(H+)=
| ||
| △t |
(2)①向0.1mol/L的醋酸溶液中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液时,能够中和氢离子,平衡正向移动,醋酸的电离百分数增大;
②0.1mol/L的醋酸溶液的pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,据Ka=
| [H+]?[CH3COO-] |
| [CH3COOH] |
(3)原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子;在铁片上镀铜时,铁片做阴极,接电源的负极,生成19.2g铜时,转移电子0.6mol,据电子守恒计算消耗乙醇的质量.
解答:
解:(1)①(3)最初NO3-为0.8mol,故图中曲线表示NO3-物质的量的变化,故答案为:NO3-;
②当反应消耗0.2mol铁时,发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,生成硝酸物质的量为0.8mol,氢离子为0.8mol,v(H+)=
=
=1.0 mol?L-1?min-1,故答案为:1.0 mol?L-1?min-1;
(2)①向0.1mol/L的醋酸溶液中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液时,能够中和氢离子,平衡正向移动,醋酸的电离百分数增大,图象为 ,故答案为:
,故答案为: ;
;
②0.1mol/L的醋酸溶液的pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,据Ka=
=
=1.0×10-5;pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,则醋酸的电离度为
=1%,故答案为:1.0×10-5;1%;
(3)原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,电极反应式为C2H5OH-12eˉ+16OHˉ=2CO32ˉ+11H2O;在铁片上镀铜时,铁片做阴极,接电源的负极C1;生成19.2g铜时,转移电子0.6mol,据负极电极反应式可知,消耗乙醇物质的量为0.5mol,质量为2.3g,
故答案为:C2H5OH-12eˉ+16OHˉ=2CO32ˉ+11H2O;C1;2.3.
②当反应消耗0.2mol铁时,发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,生成硝酸物质的量为0.8mol,氢离子为0.8mol,v(H+)=
| ||
| △t |
| ||
| 2min |
(2)①向0.1mol/L的醋酸溶液中慢慢滴加0.10mol?Lˉ1的稀氢氧化钠溶液时,能够中和氢离子,平衡正向移动,醋酸的电离百分数增大,图象为
 ,故答案为:
,故答案为: ;
;②0.1mol/L的醋酸溶液的pH=3,则c(CH3COO-)=c(H+)=0.001mol/L,据Ka=
| [H+]?[CH3COO-] |
| [CH3COOH] |
| 0.001×0.001 |
| 0.1-0.001 |
| 0.001mol/L |
| 0.1mol/L |
(3)原电池中负极上燃料失电子,碱性条件下,CH3CH2OH反应生成碳酸根离子,电极反应式为C2H5OH-12eˉ+16OHˉ=2CO32ˉ+11H2O;在铁片上镀铜时,铁片做阴极,接电源的负极C1;生成19.2g铜时,转移电子0.6mol,据负极电极反应式可知,消耗乙醇物质的量为0.5mol,质量为2.3g,
故答案为:C2H5OH-12eˉ+16OHˉ=2CO32ˉ+11H2O;C1;2.3.
点评:本题考查了氧化还原反应中电子守恒的应用、弱电解质的电离平衡的移动、电离平衡常数的计算、电极反应式的书写,题目难度较大.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
下列叙述正确的是( )
| A、钢管与电源正极连接,可对钢管进行电化学保护 |
| B、利用高压氧舱治疗煤气中毒是依据平衡移动原理 |
| C、配制氯化亚锡(SnCl2)溶液时需加适量盐酸防止被氧化变浑浊 |
| D、用Fe除去溶液中的Cu2+、Hg2+与用FeS除去溶液中的Cu2+、Hg2+的原理相同 |
下列有机物的系统名称中,正确的是( )
| A、2,4,4-三甲基戊烷 |
| B、4-甲基-2-戊烯 |
| C、3-甲基-5-异丙基庚烷 |
| D、1,2,4-三甲基丁烷 |
25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是( )
| A、稀释后溶液的pH=7 | ||||
| B、氨水的电离度增大,溶液中所有离子的浓度均减小 | ||||
C、稀释过程中
| ||||
| D、pH=11氨水的浓度为0.001mol/L |
下列说法正确的是( )
| A、2-甲基丙烷的一氯取代物有两种 |
B、 和 和 互为同系物 互为同系物 |
| C、顺-2-丁烯与反-2-丁烯与氢气加成的产物不相同 |
D、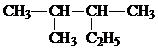 的名称为2-甲基-3-乙基丁烷 的名称为2-甲基-3-乙基丁烷 |
①-OH ②OH- ③-Br ④-CH3 ⑤ ⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )
 ⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )
⑥-C6H5 ⑦Br-⑧-COOH 其中不是官能团的是( )| A、①③⑤⑧ | B、②④⑦ |
| C、②③⑤⑦⑧ | D、②④⑥⑦ |