题目内容
硫酸氢钠(NaHSO4)也称酸式硫酸钠,它的水溶液显酸性.氢氧化钡是能溶于水的强碱之一.
(1)写出硫酸氢钠、氢氧化钡在水溶液中的电离方程式:
NaHSO4: 、Ba(OH)2: ;
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,有白色沉淀产生,写出产生白色沉淀的离子方程式: ;
(3)为测定NaHSO4溶液的物质的量浓度,需要配制0.2mol?L-1的Ba(OH)2溶液100mL,如果用托盘天平称量,则需要称取Ba(OH)2?8H2O的质量为 克;
(4)现有0.2mol?L-1的NaHSO4溶液100mL,向其中逐滴加入0.2mol?L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行.当加入50mLBa(OH)2溶液时,所得溶液中的溶质是 ;
(5)写出一个与离子方程式Ba2++OH-+H++SO42-=BaSO4↓+H2O相对应的化学方程式: .
(1)写出硫酸氢钠、氢氧化钡在水溶液中的电离方程式:
NaHSO4:
(2)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,有白色沉淀产生,写出产生白色沉淀的离子方程式:
(3)为测定NaHSO4溶液的物质的量浓度,需要配制0.2mol?L-1的Ba(OH)2溶液100mL,如果用托盘天平称量,则需要称取Ba(OH)2?8H2O的质量为
(4)现有0.2mol?L-1的NaHSO4溶液100mL,向其中逐滴加入0.2mol?L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行.当加入50mLBa(OH)2溶液时,所得溶液中的溶质是
(5)写出一个与离子方程式Ba2++OH-+H++SO42-=BaSO4↓+H2O相对应的化学方程式:
考点:离子方程式的书写,电离方程式的书写,物质的量浓度的相关计算
专题:离子反应专题
分析:(1)多元强酸酸式盐在水溶液中完全电离,氢氧化钡为强碱完全电离;
(2)钡离子和硫酸根离子反应产生白色沉淀;
(3)根据物质的量守恒来求解,托盘天平称量时精确度为0.1g;
(4)0.2mol?L-1的NaHSO4溶液100mL,溶质的物质的量为0.02mol,50mLBa(OH)2溶液溶质物质的是为0.01mol,由此可知氢离子和氢氧根离子恰好完全反应,钡离子完全反应,得到0.02mol的钠离子和0.01mol的硫酸根离子;
(4)因为氢离子和钠离子之比为1:1,符合组成之比,即硫酸氢钠少量,所以是少量的硫酸氢钠和氢氧化钡反应的离子方程式.
(2)钡离子和硫酸根离子反应产生白色沉淀;
(3)根据物质的量守恒来求解,托盘天平称量时精确度为0.1g;
(4)0.2mol?L-1的NaHSO4溶液100mL,溶质的物质的量为0.02mol,50mLBa(OH)2溶液溶质物质的是为0.01mol,由此可知氢离子和氢氧根离子恰好完全反应,钡离子完全反应,得到0.02mol的钠离子和0.01mol的硫酸根离子;
(4)因为氢离子和钠离子之比为1:1,符合组成之比,即硫酸氢钠少量,所以是少量的硫酸氢钠和氢氧化钡反应的离子方程式.
解答:
解:(1)多元强酸酸式盐在水溶液中完全电离,氢氧化钡为强碱完全电离,所以电离方程式分别为NaHSO4=Na++H++SO42-、Ba(OH)2=Ba2++2OH-,
故答案为:NaHSO4=Na++H++SO42-; Ba(OH)2=Ba2++2OH-;
(2)钡离子和硫酸根离子反应产生白色沉淀,方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓;
(3)Ba(OH)2~Ba(OH)2?8H2O,所以n[Ba(OH)2?8H2O]=n(Ba(OH)2)=10-3L/mL×100mL×0.2mol?L-1=0.02mol,所以质量为0.02mol×315g/mol=6.3g,故答案为:6.3;
(4)0.2mol?L-1的NaHSO4溶液100mL,溶质的物质的量为0.02mol,50mLBa(OH)2溶液溶质物质的是为0.01mol,由此可知氢离子和氢氧根离子恰好完全反应,钡离子完全反应,得到0.02mol的钠离子和0.01mol的硫酸根离子,所以溶质为:Na2SO4,故答案为:Na2SO4;
(5)因为氢离子和钠离子之比为1:1,符合组成之比,即硫酸氢钠少量,所以是少量的硫酸氢钠和氢氧化钡反应的离子方程式,方程式为Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,故答案为:Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH.
故答案为:NaHSO4=Na++H++SO42-; Ba(OH)2=Ba2++2OH-;
(2)钡离子和硫酸根离子反应产生白色沉淀,方程式为:Ba2++SO42-=BaSO4↓,故答案为:Ba2++SO42-=BaSO4↓;
(3)Ba(OH)2~Ba(OH)2?8H2O,所以n[Ba(OH)2?8H2O]=n(Ba(OH)2)=10-3L/mL×100mL×0.2mol?L-1=0.02mol,所以质量为0.02mol×315g/mol=6.3g,故答案为:6.3;
(4)0.2mol?L-1的NaHSO4溶液100mL,溶质的物质的量为0.02mol,50mLBa(OH)2溶液溶质物质的是为0.01mol,由此可知氢离子和氢氧根离子恰好完全反应,钡离子完全反应,得到0.02mol的钠离子和0.01mol的硫酸根离子,所以溶质为:Na2SO4,故答案为:Na2SO4;
(5)因为氢离子和钠离子之比为1:1,符合组成之比,即硫酸氢钠少量,所以是少量的硫酸氢钠和氢氧化钡反应的离子方程式,方程式为Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,故答案为:Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
相关题目
下列表示物质结构的化学用语或模型正确的是( )
A、NaCl的电子式: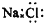 |
| B、乙烯的结构式:CH2=CH2 |
C、S2-结构示意图: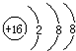 |
D、CH4分子的球棍模型: |
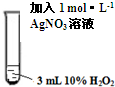

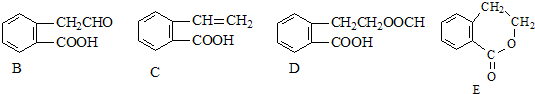
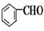 +CH3CHO
+CH3CHO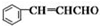 +H2O
+H2O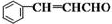 侧链上可能发生反应的类型:
侧链上可能发生反应的类型: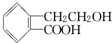 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质.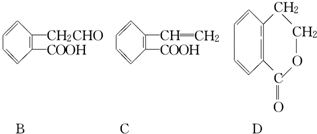
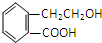 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.