题目内容
9.由A、B、C、D四种金属按下表中装置进行实验.| 装置 | 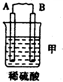 | 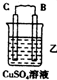 | 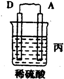 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
①装置乙中正极的电极反应式是Cu2++2e-═Cu.
②四种金属活动性由强到弱的顺序是D>A>B>C.
分析 甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,
作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C.
解答 解:甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;
乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;
丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,
作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C;
①乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
②通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,故答案为:D>A>B>C.
点评 本题考查了原电池原理,根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
19.下列关于化学能转化为电能的四种装置的说法正确的是( )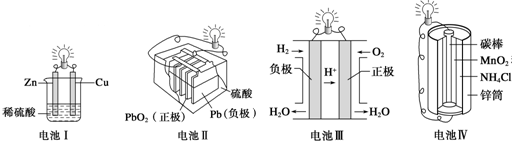

| A. | 电池Ⅰ中锌是负极 | |
| B. | 电池Ⅱ是一次电池 | |
| C. | 电池Ⅲ工作时氢气发生还原反应 | |
| D. | 电池Ⅳ工作时电子由锌通过导线流向碳棒 |
20.Na与H2O反应现象明显,下列现象中不符合事实的是( )
| A. | 滴加了酚酞的溶液变红色 | B. | 产生气体推动Na游动 | ||
| C. | Na沉在水下 | D. | Na熔成光亮小球 |
17.以下化合物中,既含有离子键,又含有极性键的是( )
| A. | NaOH | B. | Na2O2 | C. | MgCl2 | D. | H2O2 |
4.下列物质属于同系物的是( )
| A. |  和 和 | B. | CH3CH2Cl和CH2ClCH2Cl | ||
| C. | C2H6和C5H12 | D. | CH3CH2OH和CH3Cl |
13.短周期主族元素W、R、X、Y、Z,原子序数依次增大.W、X、Y三种元素原子的最外层电子数之和为15,Y原子核电荷数等于W原子核电荷数的2倍,R原子最外层电子数与X原子最外层电子数相差1.下列叙述正确的是( )
| A. | R在化合物中显+1价 | B. | 最高价氧化物的水化物的碱性:X>R | ||
| C. | 原子半径:W<R<X | D. | R与Z可以形成离子化合物 |