题目内容
15.下列物质中含有离子键的是( )| A. | H2O | B. | MgCl2 | C. | CO2 | D. | N2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族(H元素除外)、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.水分子中H-O原子之间只存在共价键,为共价化合物,故A不选;
B.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故B选;
C.二氧化碳分子中C-O原子之间只存在共价键,为共价化合物,故C不选;
D.氮气分子中N-N原子之间只存在共价键,为单质,故D不选;
故选B.
点评 本题考查离子键判断,为高频考点,侧重考查基本概念,明确离子键和共价键的区别,注意不能根据是否含有金属元素判断离子键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.下列有关元素的性质及其递变规律正确的是( )
| A. | IA族与ⅦA族元素间形成的化合物都是离子化合物 | |
| B. | 第三周期元素从左到右,最高正价从+1递增到+7 | |
| C. | 同主族元素的简单阴离子从上到下还原性减弱 | |
| D. | 同周期金属元素的化合价越高,其原子失电子能力越强 |
6.在25℃、101k Pa下,0.2mol C2H2完全燃烧生成CO2和H2O(l)时放出259.92kJ热量.表示上述反应的热化学方程式正确的是( )
| A. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(g)△H=+259.92 kJ/mol | |
| B. | 0.2C2H2(g)+0.5O2(g)═0.4CO2(g)+0.2H2O(l)△H=-259.92 kJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=+2599.2 kJ/mol | |
| D. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599.2 kJ/mol |
3.短周期主族元素A、B、C、D、E的原子序数依次递增,A的单质在常温下呈气态,D元素的单质既能与盐酸反应也能与NaOH溶液反应,B、C、E原子的最外层电子数之和为13,E原子的最外层电子数是B原子内层电子数的3倍或是C原子最外层电子数的3倍.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(B)>r(C)>r(A) | |
| B. | 元素E的氧化物的水化物一定是强酸 | |
| C. | D单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | C、D的氯化物都是离子化合物 |
10.100mL 6mol/L硫酸溶液与过量锌粉反应,在一定温度下,为了减缓反应速率但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 加入硫酸钠固体 | B. | 加入水 | ||
| C. | 加入100mL 1mol/L硫酸 | D. | 把锌粉换成锌粒 |
20.下列叙述中能肯定说明金属A比金属B的活泼性强的是( )
| A. | A原子最外层外层电子数比B原子最外层外层电子数少 | |
| B. | A原子电子层数比B原子电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的氢气比1molB从酸中置换生成的氢气多 |
7.下列关于氨气的说法中正确的是( )
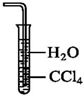

| A. | 氨气溶于水显碱性,所以氨气可以使湿润的酚酞试纸变蓝 | |
| B. | 氨气可以用浓硫酸干燥 | |
| C. | 用水吸收氨气可用如图的装置防止倒吸 | |
| D. | 氨气本身没有毒,因此氨气泄漏时,人们没有必要采取任何防范措施 |
4.下列变化不能用勒夏特列原理解释的是( )
| A. | 红棕色的NO2气体加压后颜色先变深再变浅 | |
| B. | 实验室中常用饱和食盐水除去Cl2中混有的HCl | |
| C. | 二氧化硫转化为三氧化硫时增加空气的量以提高二氧化硫的转化率 | |
| D. | H2、I2、HI混合气体加压后颜色变深 |
 3,3,4-三甲基己烷.
3,3,4-三甲基己烷.