题目内容
11.将氯化银加到溴化钠溶液中,白色不溶物变为淡黄色,把此淡黄色不溶物加到碘化钾溶液中,淡黄色不溶物变为黄色不溶物.此实验方案为了验证( )| A. | 活动性:Cl->Br->I- | B. | 还原性:I->Br->Cl- | ||
| C. | 稳定性:AgCl>AgBr>AgI | D. | Ksp:AgCl>AgBr>AgI |
分析 白色不溶物变为淡黄色,淡黄色不溶物变为黄色不溶物,即白色沉淀AgCl→淡黄色沉淀AgBr→黄色沉淀AgI,均发生沉淀的转化,以此来解答.
解答 解:白色不溶物变为淡黄色,淡黄色不溶物变为黄色不溶物,即白色沉淀AgCl→淡黄色沉淀AgBr→黄色沉淀AgI,均发生沉淀的转化,向溶度积更小的方向移动,则可知Ksp:AgCl>AgBr>AgI,由实验现象不能确定离子的还原性、活动性及卤化银的稳定性,
故选D.
点评 本题考查沉淀的转化,为高频考点,把握反应现象与沉淀转化的原因为解答的关键,侧重分析与应用能力的考查,注意溶度积的比较,题目难度不大.

练习册系列答案
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
1.1999年4月,俄、美科学家宣布用86Kr核轰击208Pb靶合成了118号元素的一个同位素${\;}_{118}^{293}$Pb,关于118号元素的下列说法正确的是( )
| A. | 118号元素的相对原子质量为293 | |
| B. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的质量数为293 | |
| C. | 118号元素的一种同位素${\;}_{118}^{293}$Pb的中子数为293 | |
| D. | 118号元素应为周期表中第8周期的元素 |
19.金刚石的熔点低于石墨,原因可能是 ( )
| A. | 石墨中还有范德华力 | |
| B. | 石墨熔化也要破坏共价键,且键长更短 | |
| C. | 石墨热稳定性更好 |
6.在化学的发展史上,许多科学家创建的理论对化学科学的发展起到重大的作用.有关科学家与其创建的理论对应不匹配的是( )
| A. | 墨子:物质的分割是有条件的 | B. | 汤姆生:葡萄干面包模型 | ||
| C. | 德谟克利特:古典原子论 | D. | 贝克勒尔:原子结构的行星模型 |
3.下列电解质在水中的电离方程式书写正确的是( )
| A. | KHSO4═K++H++SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | Mg(NO3)2═Mg2++(NO3)22- | D. | KClO3═K++Cl5-+3O2- |
20.有一种滋补品,其有效成分的结构简式如图,下列对该化合物的叙述不正确的是( )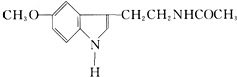

| A. | 它属于芳香族化合物 | B. | 它属于高分子化合物 | ||
| C. | 分子式为C13N2H16O2 | D. | 在一定条件下可以发生加成反应 |
1.只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液,这种试剂是( )
| A. | NaOH | B. | H2SO4 | C. | BaCl2 | D. | AgNO3 |