题目内容
4.下列装置所示的实验中,能达到实验目的是( )| A. |  分离碘和酒精 | B. |  除去Cl2中的H Cl碘酒 | ||
| C. |  收集NO | D. |  实验室制取NH3 |
分析 A.碘酒不分层;
B.二者均与NaOH反应;
C.NO不溶于水,短进长出可排出水;
D.氯化铵分解后,在试管口又化合生成氯化铵.
解答 解:A.碘酒不分层,则不能利用图中分液漏斗分离,故A错误;
B.二者均与NaOH反应,不能除杂,应选饱和食盐水,故B错误;
C.NO不溶于水,短进长出可排出水,图中装置可收集NO,故C正确;
D.氯化铵分解后,在试管口又化合生成氯化铵,不能制备氨气,应选氯化铵与碱共热制备,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、气体收集、气体的制备实验、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度不大.

练习册系列答案
相关题目
15.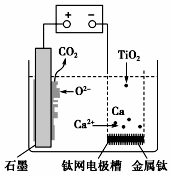 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
 研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用图示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛.下列说法中错误的是( )| A. | 在制备金属钛前后,整套装置中CaO的总量保持不变 | |
| B. | 阳极的电极反应式为C+2O2--4e-═CO2↑ | |
| C. | 由TiO2制得1 mol金属Ti,理论上外电路通过2 mol 电子 | |
| D. | 若用铅蓄电池作供电电源,“-”接线柱应连接Pb电极 |
12.下列离子方程式表示正确的是( )
| A. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| B. | 室温下,氯化铵溶液显酸性的理由:NH4++H2O═NH3•H2O+H+ | |
| C. | 泡沫灭火器的反应原理:Al3++3HCO3-═3CO2↑+Al(OH)3↓ | |
| D. | 用铜作电极电解饱和食盐水:2Cl-+H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- |
19.已知:C(s)+H2O(g)=CO(g)+H2(g)△H=+130KJ/mol
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
2C(s)+O2(g)=2CO(g)△H=-220KJ/mol
H-H、O=O和O-H键的键能分别为aKJ/mol、496KJ/mol和462KJ/mol,则a为( )
| A. | 190 | B. | 218 | C. | 436 | D. | 463 |
16.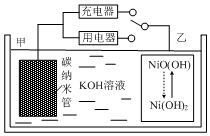 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
 2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )
2016年8月,联合国开发计划署在中国的首个“氢经济示范城市”在江苏落户.用吸附了H2的碳纳米管等材料制作的二次电池的原理如图所示.下列说法正确的是( )| A. | 放电时,甲电极为正极,OH-移向乙电极 | |
| B. | 放电时,乙电极反应为:Ni(OH)2+OH--e-=NiO(OH)+H2O | |
| C. | 充电时,电池的碳电极与直流电源的正极相连 | |
| D. | 电池总反应为H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2 |
13.下列说法不正确的是( )
| A. | 可以利用铝热反应冶炼高熔点的金属 | |
| B. | 现代石油化工,采作银作催化剂可以实现一步完成乙烯转化为环氧乙烷的过程,该反应的原子利用率为100% | |
| C. | 工业上制溴是向酸化的浓缩海水中直接通入氯气置换出溴即可 | |
| D. | 煤直接液化可得液体燃料 |
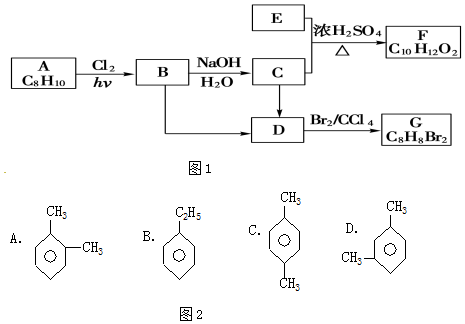
 ;
; ;
;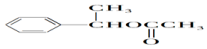 ;
; (结构简式).
(结构简式). (2)KFK+
(2)KFK+
 (4)Na2S
(4)Na2S
 (6)CaCl2
(6)CaCl2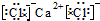 .
.