题目内容
9.KClO3和浓盐酸在一定温度下发生如(1)的反应:(1)请配平方程式,并用双线桥表示得失电子情况:
2KClO3+4HCl(浓)=2KCl+2ClO2↑+1Cl2↑+2H2O
(2)氧化剂是KClO3,还原产物是ClO2(写化学式).
(3)产生0.1molCl2时,转移电子的物质的量为0.2mol.
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;再结合元素守恒,配平各物质的系数.
(2)含元素化合价降低的物质为氧化剂,对应还原产物;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量.
解答 解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,水的系数是2.电子转移的方向和数目为:
故答案为:2;4;2;2;1;2; ;
;
(2)KClO3中氯元素化合价降低,为氧化剂,对应生成ClO2为还原产物,故答案为:KClO3;ClO2;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol.
故答案为:0.2.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
相关题目
19.下列离子方程式正确的是( )
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| B. | Fe2(SO4)3和Ba(OH)2溶液混合:2Fe3++3SO42-+3Ba2++6OH-═2Fe(OH)3↓+3BaSO4↓ | |
| C. | 硫酸工厂尾气中的SO2用过量的氨水吸收:2NH3•H2O+SO2═2NH4++SO32-+H2O | |
| D. | Cu溶于浓HNO3:Cu+4H++2NO3-═Cu2++2NO↑+4H2O |
20.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 34gH2O2中含有的阴离子数为1NA | |
| B. | 4.6g乙醇中含有的C-H键的个数为0.6NA | |
| C. | 标准状况下,VL水含有的氧原子个数约为$\frac{V}{22.4}$ | |
| D. | 1molFe2+与足量的H2O2溶液反应,转移NA个电子 |
17.如图是某同学设计的原电池装置,下列叙述中不正确的是( )
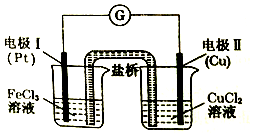

| A. | 盐桥中装有含氯化钾的琼脂,K+移向左池,Cl-移向右池 | |
| B. | 电极I上发生还原反应,电极反应式:Fe3++3e-=Fe | |
| C. | 电极Ⅱ作负极,铜电极逐渐溶解 | |
| D. | 该原电池的总反应为2 Fe3++Cu=Cu2++2Fe2+ |
4.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘和酒精 | B. |  除去Cl2中的H Cl碘酒 | ||
| C. |  收集NO | D. |  实验室制取NH3 |
14.下列离子方程式书写正确的( )
| A. | 沸水中滴入FeCl3饱和溶液:Fe3++3H2O$\frac{\underline{\;△\;}}{\;}$Fe(OH)3↓+3H+ | |
| B. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 用氢氧化钠溶液吸收过量二氧化碳:OH-+CO2═HCO${\;}_{3}^{-}$ | |
| D. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
1.“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出 现甚至具有里程碑式划时代的意义.请回答下列问题:
Ⅰ、(1)石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成 CaO•3MgO•4SiO2.
(2)高分子材料可以分成无机高分子材料和有机高分子材料.[AlFe(OH)n Cl6-n]m属于 无机高分子材料,是一种新型高效净水剂,它广泛应 用生活用水和工业污水的处 理,其中铁元素的化合价为+3;
Ⅱ、高纯二氧化硅可用来制造光纤.某稻壳灰的成分为:
通过如下流程可由稻壳灰制备较纯净的二氧化硅.
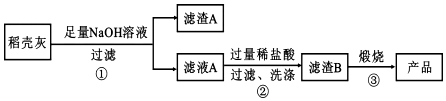
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是Al2O3.
(2)步骤①中涉及 SiO2的离子反应方程式为SiO2+2OH-═SiO32-+H2O.
(3)滤渣 A 的成分有C和Fe2O3(填化学式)
Ⅰ、(1)石棉(CaMg3Si4O12)是常用的耐火材料,用氧化物的形式表示其组成 CaO•3MgO•4SiO2.
(2)高分子材料可以分成无机高分子材料和有机高分子材料.[AlFe(OH)n Cl6-n]m属于 无机高分子材料,是一种新型高效净水剂,它广泛应 用生活用水和工业污水的处 理,其中铁元素的化合价为+3;
Ⅱ、高纯二氧化硅可用来制造光纤.某稻壳灰的成分为:
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数/% | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中属于两性氧化物的是Al2O3.
(2)步骤①中涉及 SiO2的离子反应方程式为SiO2+2OH-═SiO32-+H2O.
(3)滤渣 A 的成分有C和Fe2O3(填化学式)
18.下列关于物质性质的表述正确的是( )
| A. | 向含有少量KSCN的FeI2溶液中滴加少量溴水,溶液出现血红色 | |
| B. | 用NH4HCO3固体以及其他固体药品能制得纯净的NH3 | |
| C. | 将SO2通入酸性KMnO4溶液中,溶液褪色,体现了SO2的漂白性 | |
| D. | 加热条件下,过量的Fe与浓硫酸反应只生成SO2一种气体 |
13.表第I栏与第II栏中的化学反应,都可以用第III栏中的离子方程式表示的是( )
| 选项 | 第I栏 | 第II栏 | 第Ⅲ栏 |
| A | 往少量NaOH溶液中投入铝片 | 往过量NaOH溶液中 投入铝片 | 2Al+2OH-+2H2O═2AlO2-+3H2↑ |
| B | 往Fe2( SO4)3溶液 中滴入氢氧化钠溶液 | 往Fe2 (SO4)3溶液 中滴入氢氧化钡溶 液 | Fe3++3OH=Fe(OH)3↓ |
| C | NaHCO3溶液滴入Ca(OH)2 | NaHCO3溶液滴入NaOH溶液 | Ca2++OH-+HCO3-=CaCO3↓+H2O |
| D | 往NaOH泪液中通入过量CO2气体 | 往NaOH溶液中通入少量CO2气体 | CO2+OH-=HCO3- |
| A. | A | B. | B | C. | C | D. | D |