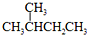题目内容
下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y, 分别与足量的盐酸反应 |
X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 | 溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.产生氢气多少与失去电子的多少有关,不能比较金属性;
B.KCl溶液为中性溶液;
C.CuSO4溶液中加入KI溶液,发生氧化还原反应生成CuI沉淀和碘单质;
D.久置的Na2O2粉末混有碳酸钠,二者均与盐酸反应生成气体.
B.KCl溶液为中性溶液;
C.CuSO4溶液中加入KI溶液,发生氧化还原反应生成CuI沉淀和碘单质;
D.久置的Na2O2粉末混有碳酸钠,二者均与盐酸反应生成气体.
解答:
解:A.产生氢气多少与失去电子的多少有关,不能比较金属性,应利用生成氢气的速率比较金属性,故A错误;
B.KCl溶液为中性溶液,若滴有甲基橙的AgNO3溶液显红色,加KCl反应生成沉淀和硝酸,酸性增强,不会变为黄色,故B错误;
C.CuSO4溶液中加入KI溶液,发生氧化还原反应生成CuI沉淀和碘单质,再加入苯,振荡,有白色沉淀生成,苯层呈紫色,故C正确;
D.久置的Na2O2粉末混有碳酸钠,二者均与盐酸反应生成气体,则产生气体不能检验是否变质,故D错误;
故选C.
B.KCl溶液为中性溶液,若滴有甲基橙的AgNO3溶液显红色,加KCl反应生成沉淀和硝酸,酸性增强,不会变为黄色,故B错误;
C.CuSO4溶液中加入KI溶液,发生氧化还原反应生成CuI沉淀和碘单质,再加入苯,振荡,有白色沉淀生成,苯层呈紫色,故C正确;
D.久置的Na2O2粉末混有碳酸钠,二者均与盐酸反应生成气体,则产生气体不能检验是否变质,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及金属性比较、氧化还原反应、复分解反应等,把握物质的性质及反应原理为解答的关键,注意实验方案的评价性、操作性分析,题目难度不大.

练习册系列答案
相关题目
下列关于原电池说法正确的是( )
| A、由Al、Mg、稀硫酸组成的原电池,其负极反应式为:Al-3e-═Al3+ |
| B、由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH-═Al(OH)3↓ |
| C、由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e-═Cu2+ |
| D、由Fe、Cu、FeCl3组成的原电池,其正极反应式为:Cu-2e-═Cu2+ |
化学在生产和日常生活中有着重要的应用.下列说法不正确的是( )
| A、二氧化硅是光纤制品的基本原料 |
| B、水玻璃可用作黏合剂和防火剂 |
| C、电解NaCl饱和溶液,可制得金属钠 |
| D、Al2O3的熔点很高,是一种耐火材料 |
下列各组物质,按化合物、单质、混合物顺序排列的是( )
| A、烧碱 液态氧 碘酒 |
| B、生石灰 白磷 熟石灰 |
| C、干冰 铁 氯化氢 |
| D、空气 氮气 胆矾 |
有关2L 0.1mol?L-1的K2SO4溶液的叙述正确的是( )
| A、K+的物质的量为0.1mol | ||
B、倒出1 L溶液后,浓度变为原来的
| ||
| C、K+的物质的量浓度为0.1mol/L | ||
| D、含有0.2mol K2SO4 |
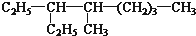
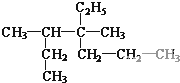
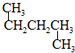 和
和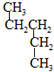
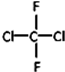 和
和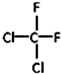 ⑦CH3CH2CH2CH3和
⑦CH3CH2CH2CH3和