题目内容
15.A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期,A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;若B的阳离子比C的阴离子少一个电子层,下列叙述正确的是( )| A. | 原子序数:A>B>D>C | B. | 金属性B>D,非金属性A>C | ||
| C. | 原子半径:D>B>C>A | D. | 简单离子半径:C>B>D>A |
分析 A、B、C、D为四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;
B的阳离子比C的阴离子少一个电子层,则B处于第三周期,且为金属元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性B<D,故原子序数B>D,据此解答.
解答 解:A、B、C、D为四种短周期元素,A、C同主族,A的气态氢化物比C的气态氢化物稳定,故A、C为非金属,原子序数C>A,A处于第二周期,C处于第三周期;B的阳离子比C的阴离子少一个电子层,则B处于第三周期,且为金属元素,B、D同周期,B的阳离子比D的阳离子氧化性强,则金属性B<D.
A.A处于第二周期,B、C、D处于第三周期,A的原子序数最小,B、D为金属、C为非金属,金属性B<D,同周期自左而右金属性减弱、非金属性增强,故原子序数C>D>B,所以原子序数:C>B>D>A,故A错误;
B.B的阳离子比D的阳离子氧化性强,则金属性B<D,A、C同主族,A的气态氢化物比C的气态氢化物稳定,非金属A>C,故B错误;
C.同周期从左到右元素原子半径逐渐减小,所以半径:D>B>C,同主族从上到下原子半径逐渐增大,所以C>A,则原子半径:D>B>C>A,故C正确;
D.核外电子排布相同时,核电荷数越小,离子的半径越大,电子层数越多,离子半径越大,A、B、D的核外电子排布相同,C的核外电子排布相同比A、B、C多一个电子层,原子序数:C>B>D>A,所以离子半径:C>A>D>B,故D错误;
故选:C.
点评 本题考查元素周期表的结构、元素周期律等,确定元素的相对位置关系,注意对元素周期律理解掌握,知道离子半径大小比较方法.

练习册系列答案
相关题目
8.某饱和一元醇和一元醛的混合物共3g,跟足量的银氨溶液完全反应后,可还原出16.2gAg,下列说法正确的是( )
| A. | 一定是甲醛 | B. | 可能是乙醛 | ||
| C. | 混合物中二者的质量比是1:3 | D. | 不可能有此种醛 |
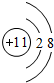
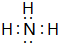 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.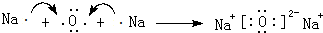 .
. X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
X、Y、Z、R为短周期元素,原子序数依次增大.X的基态原子的s能级电子数是p能级电子数的2倍;Y的单质在空气中含量最高;Z的氧化物是常见的两性氧化物;R基态原子最外层成对电子的数目和未成对电子的数目相等.
 ,⑥与⑨形成的5原子分子的结构式为
,⑥与⑨形成的5原子分子的结构式为 .
.