题目内容
11.下列离子方程式中正确的是( )| A. | 将亚硫酸钡加入到盐酸中:SO${\;}_{3}^{2-}$+2H+=SO2↑+H2O | |
| B. | 金属钾与水反应:K+H2O=K++OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铜屑:Cu+4H++NO-3=Cu2++2H2O+NO↑ | |
| D. | 向偏铝酸钠溶液中通过量CO2:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3 |
分析 A.亚硫酸钡为沉淀,应保留化学式;
B.原子个数不守恒;
C.电荷不守恒;
D.二氧化碳过量,反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:A.将亚硫酸钡加入到盐酸中,离子方程式:BaSO3+2H+=SO2↑+H2O+Ba2+,故A错误;
B.金属钾与水反应,离子方程式:2K+2H2O=2K++2OH-+H2↑,故B错误;
C.向稀硝酸中加入少量铜屑,离子方程式:3Cu+8H++2NO-3=3Cu2++4H2O+2NO↑,故C错误;
D.向偏铝酸钠溶液中通过量CO2,离子方程式:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
4.下列电子式正确的是( )
| A. | H:Cl | B. | H[:O:]2- H | C. | Mg2+  2 2 | D. | Na+  |
5.将-CH3、-OH、-COOH、 四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
 四种原子团两两结合,所得化合物水溶液呈酸性的共有( )
四种原子团两两结合,所得化合物水溶液呈酸性的共有( )| A. | 3种 | B. | .4种 | C. | .5种 | D. | .6种 |
20.在一定温度下的恒容容器中进行反应:A(g)+2B(g)?C(g)+D(g),当下列哪些物理量不再发生变化时,能表明该可逆反应已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总体积
⑤混合气体总物质的量 ⑥混合气体的平均相对分子质量 ⑦混合气体总质量.
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④混合气体总体积
⑤混合气体总物质的量 ⑥混合气体的平均相对分子质量 ⑦混合气体总质量.
| A. | ①③⑤⑥ | B. | ①②④⑦ | C. | ①②③④⑤⑥⑦ | D. | ①②③④⑤ |
6.只用一种试剂就能将甲苯、己烯、四氯化碳、碘化钾溶液区分开,该试剂可以是( )
| A. | 高锰酸钾溶液 | B. | 溴化钾溶液 | C. | 溴水 | D. | 硝酸银溶液 |
3.下列离子方程式正确的是( )
| A. | Si投入NaOH溶液中Si+2OH-═SiO${\;}_{3}^{2-}$+H2 | |
| B. | 把Al中投入到少量氢氧化钠溶液Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42-”完全沉淀:Al3++2SO42-+2Ba2++2OH-═2BaSO4↓+Al(OH)3 | |
| D. | Na[Al(OH)4]溶液中加入过量的CO2:[Al(OH)4]-+CO2═HCO${\;}_{3}^{-}$+Al(OH)3↓ |
20.NA代表阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 18gH20中含有的中子数为10NA | |
| B. | 6.4g铜完全溶解于一定浓度的硝酸时,转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的Na2CO3溶液中,离子总数为0.3NA | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ•mol-1,若投入NA个HI分子,反应平衡时,吸热7.45kJ |

 +(2n-1)H2O.
+(2n-1)H2O. .
.
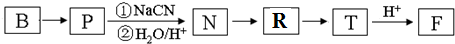
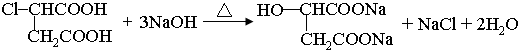 .
. C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( )