题目内容
3.下列离子方程式正确的是( )| A. | Si投入NaOH溶液中Si+2OH-═SiO${\;}_{3}^{2-}$+H2 | |
| B. | 把Al中投入到少量氢氧化钠溶液Al3++3OH-═Al(OH)3↓ | |
| C. | 向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42-”完全沉淀:Al3++2SO42-+2Ba2++2OH-═2BaSO4↓+Al(OH)3 | |
| D. | Na[Al(OH)4]溶液中加入过量的CO2:[Al(OH)4]-+CO2═HCO${\;}_{3}^{-}$+Al(OH)3↓ |
分析 A.漏写氧化剂水;
B.反应生成偏铝酸钠和氢气;
C.恰好使“SO42-”完全沉淀,反应生成硫酸钡和偏铝酸钾;
D.反应生成氢氧化铝和碳酸氢钠.
解答 解:A.Si投入NaOH溶液中的离子反应为Si+H2O+2OH-═SiO32-+2H2↑,故A错误;
B.把Al中投入到少量氢氧化钠溶液的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.向明矾水溶液中滴加氢氧化钡溶液,恰好使“SO42-”完全沉淀的离子反应为Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O,故C错误;
D.Na[Al(OH)4]溶液中加入过量的CO2的离子反应为[Al(OH)4]-+CO2═HCO3-+Al(OH)3↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
相关题目
16.某学生做实验后,采用下列方法清洗所有仪器:①用稀HNO3清洗做过银镜反应的试管,②用酒精清洗做过碘升华的烧杯,③用盐酸溶液清洗盛过苯酚的试管.你认为他的操作中,正确的有( )
| A. | ①③ | B. | ①② | C. | ②③ | D. | 全部正确 |
11.下列离子方程式中正确的是( )
| A. | 将亚硫酸钡加入到盐酸中:SO${\;}_{3}^{2-}$+2H+=SO2↑+H2O | |
| B. | 金属钾与水反应:K+H2O=K++OH-+H2↑ | |
| C. | 向稀硝酸中加入少量铜屑:Cu+4H++NO-3=Cu2++2H2O+NO↑ | |
| D. | 向偏铝酸钠溶液中通过量CO2:AlO-2+CO2+2H2O=Al(OH)3↓+HCO-3 |
18.下列离子方程式中,错误的是( )
| A. | 氯气与烧碱溶液反应:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | 在NaOH溶液中滴入几滴NH4Cl溶液:NH4++OH-═NH3•H2O | |
| C. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | 将稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
15.为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如下图.
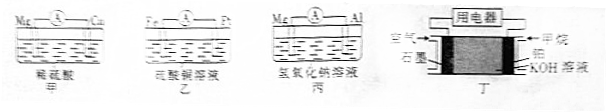
(1)根据原电池原理填写下表.
(2)电极类型除与电极材料的性质有关外,还与电解质溶液有关.
(3)根据上述电池分析,负极材料是否一定参加电极反应?不一定(填“是”“不是”或“不一定”).
(4)上述电池的放电过程中,丙中电解质溶液的碱性减弱(填“增强”“减弱”或“不变”,下同),丁中电解质溶液的碱性减弱.

(1)根据原电池原理填写下表.
| 装置序号 | 负极 | 阳离子移向 (填电极材料名称) |
| 甲 | ||
| 乙 | . |
(3)根据上述电池分析,负极材料是否一定参加电极反应?不一定(填“是”“不是”或“不一定”).
(4)上述电池的放电过程中,丙中电解质溶液的碱性减弱(填“增强”“减弱”或“不变”,下同),丁中电解质溶液的碱性减弱.
12.准确称取一定量纯净的H2C2O4•2H2O于锥形瓶中,加入适量的蒸馏水和稀硫酸,用未知浓度的高锰酸钾溶液进行滴定,从而标定高锰酸钾溶液的浓度.下列说法正确的是( )
| A. | KMnO4溶液可盛放在碱式滴定管中 | |
| B. | 可用酚酞或甲基橙作滴定的指示剂 | |
| C. | 若滴定管未用待测KMnO4溶液润洗,则会使测得的KMnO4溶液浓度偏小 | |
| D. | 滴定过程中褪色速率先慢后快,是由于锥形瓶中KMnO4溶液浓度不断增大 |
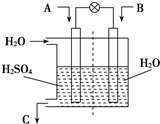 有人设想用图所示装置,运用电化学原理将CO2、SO2转化为重要化工原料.
有人设想用图所示装置,运用电化学原理将CO2、SO2转化为重要化工原料.