题目内容
11.下列离子方程式书写不正确的是( )| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
分析 A.氯气能将碘离子氧化为碘单质;
B.氯化氢为强电解质,离子方程式中应该拆开;
C.氢氧化钙在溶液中完全电离,二者反应生成氯化钙、次氯酸钙和水;
D.二氧化硫与浓盐酸在加热条件下反应生成氯化锰、氯气和水.
解答 解:A.氯气能将碘离子氧化为碘单质,反应的离子方程式为:Cl2+2I-=2Cl-+I2,故A正确;
B.盐酸与AgNO3溶液反应生成氯化银沉淀,氯化氢应该拆开,正确的离子方程式为:Cl-+Ag+=AgCl↓,故B错误;
C.氯气与氢氧化钙反应生成氯化钙和次氯酸钙,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D.实验室用二氧化锰和浓盐酸来制取氯气:实验室用二氧化锰和浓盐酸来制取氯气,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故D正确;
故选B.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列叙述中,不正确的是( )
| A. | C5H12的一种同分异构体只能生成一种一氯代物 | |
| B. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 | |
| C. | CH3-CH=CH-C≡C-CF3分子结构中6个碳原子不可能都在一条直线上 | |
| D. | 75%(体积分数)的乙醇溶液常用于医疗消毒 |
2.如图甲为锌铜原电池装置,乙为电解熔融氯化钠装置.则下列说法正确的是( )
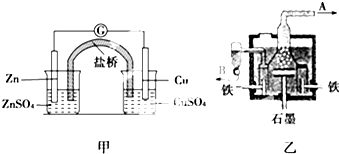

| A. | 甲装置中锌为负极,发生氧化反应,SO42-向铜极移动 | |
| B. | 乙装置中B是氯气出口,A是钠出口 | |
| C. | 乙装置中铁极为阳极,石墨为阴极 | |
| D. | 甲装置中的反应是自发反应,有化学能转化为电能;乙装置中的反应是非自发反应,有电能转化为化学能 |
19.在标准状况下,在一个容积为V L的圆底烧瓶中收集满氨气,配上塞子、导管等进行喷泉实验,烧瓶中溶液的物质的量浓度为( )
| A. | 1/22.4mol/L | B. | V/33.6mol/L | C. | V/22.4mol/L | D. | 1/33.6mol/L |
6.下列各项中表达正确的是( )
| A. | N2的结构式: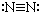 | B. | 钠离子电子式: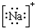 | C. | HCl的电子式: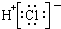 | D. | H-的结构示意图: |
16.下列关于元素周期表的说法正确的是( )
| A. | ⅠA族元素也称为碱金属元素 | |
| B. | 稀有气体元素原子的最外层电子数均为8 | |
| C. | 过渡元素全部是金属元素,因此它们又被称为过渡金属 | |
| D. | 俄国化学家道尔顿为元素周期表的建立作出了巨大贡献 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl- | |
| B. | l.0 mol•L-1 NaClO溶液:Fe2+、K+、I-、Cl- | |
| C. | 甲基橙显黄色的溶液:Na+、CO32-、NO3-、SO32- | |
| D. | 在c(OH-)/c(H+)=1×1013的溶液:NH4+、Ca2+、C1-、K+ |
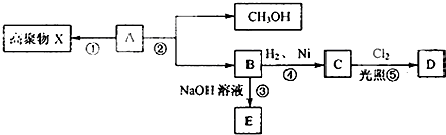 图所示的变化:
图所示的变化: CH2=CHCOOH+CH3OH.
CH2=CHCOOH+CH3OH.