题目内容
下列反应的离子方程式正确的是( )
| A、实验室中用NH4Cl与消石灰混合加热制取NH3:NH4++OH-═NH3↑+H2O |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.用NH4Cl与消石灰混合加热制取NH3,为固体加热反应原理;
B.反应生成亚硫酸氢钠;
C.过量氯气,亚铁离子、溴离子均全部被氧化;
D.少量石灰水完全反应,生成碳酸钙、碳酸钠和水.
B.反应生成亚硫酸氢钠;
C.过量氯气,亚铁离子、溴离子均全部被氧化;
D.少量石灰水完全反应,生成碳酸钙、碳酸钠和水.
解答:
解:A.用NH4Cl与消石灰混合加热制取NH3,为固体加热反应原理,没有离子参加反应,不能书写离子反应,故A错误;
B.反应生成亚硫酸氢钠,离子反应为SO2+OH-═HSO3-,故B错误;
C.过量氯气,亚铁离子、溴离子均全部被氧化,离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D.少量石灰水完全反应,生成碳酸钙、碳酸钠和水,离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+H2O,故D错误;
故选C.
B.反应生成亚硫酸氢钠,离子反应为SO2+OH-═HSO3-,故B错误;
C.过量氯气,亚铁离子、溴离子均全部被氧化,离子反应为2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D.少量石灰水完全反应,生成碳酸钙、碳酸钠和水,离子反应为2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+H2O,故D错误;
故选C.
点评:本题考查离子反应的书写正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应及氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
海洋中资源丰富,如下图所示,下列有关说法正确的是( )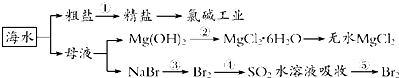
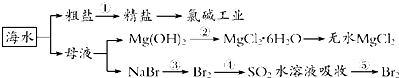
| A、工段③④⑤是溴元素的富集过程,③④⑤中均发生了氧化还原反应 |
| B、工段②中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、氯碱工业通过电解NaCl溶液,主要生产Cl2、H2和纯碱 |
| D、工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作顺序为:加入足量BaCl2溶液→加入足量NaOH溶液→加入足量Na2CO3溶液→加入足量盐酸→过滤 |
不能用H++OH-═H2O表示的离子反应的是( )
| A、氢氧化钠溶液和硫酸氢钠溶液 |
| B、氢氧化钡和硫酸溶液 |
| C、硫酸氢铵溶液和少量氢氧化钠溶液 |
| D、石灰水和硝酸溶液 |
下列有关胶体的说法错误的是( )
| A、实验室常用渗析的方法对胶体提纯 |
| B、所有的胶体均能发生电泳 |
| C、硅酸胶体中逐滴加入氢氧化钠溶液,先有沉淀生成再看到沉淀溶解 |
| D、由于土壤胶粒带负电,因此使用NH4+的肥效比NO3-高 |
把铝粉和某铁的氧化物xFeO?yFe2O3粉末配成铝热剂,分成两等份.一份在高温下恰好完全反应后,再与足量盐酸反应;另一份直接放人足量的烧碱溶液中充分反应.前后两种情况下生成的气体质量比是5:7,则x:y为( )
| A、1:2 | B、1:1 |
| C、5:7 | D、7:5 |
若用CuSO4?5H2O晶体配制450mL 0.2mol/L 的CuSO4溶液,需要CuSO4?5H2O晶体的质量为( )
| A、25g | B、16g |
| C、9g | D、22.5g |
下列叙述从化学角度分析,其中正确的是( )
| A、苯酚溶液不慎沾到皮肤上,立即用NaOH溶液洗涤 |
| B、一定条件下,稻草可制得葡萄糖或酒精 |
| C、氯化汞(HgCl2)的稀溶液不可用于手术器械消毒,因为它会使人体蛋白质变性 |
| D、氟利昂(CF2Cl2)或氮氧化物(NOx)气体会破坏大气臭氧层,从而导致“温室效应” |