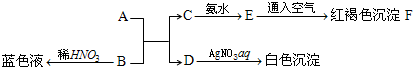
题目内容
海洋中资源丰富,如下图所示,下列有关说法正确的是( )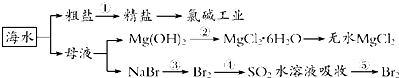
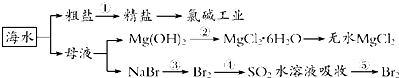
| A、工段③④⑤是溴元素的富集过程,③④⑤中均发生了氧化还原反应 |
| B、工段②中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、氯碱工业通过电解NaCl溶液,主要生产Cl2、H2和纯碱 |
| D、工段①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,操作顺序为:加入足量BaCl2溶液→加入足量NaOH溶液→加入足量Na2CO3溶液→加入足量盐酸→过滤 |
考点:海水资源及其综合利用
专题:元素及其化合物
分析:A、③溴离子被氧化为溴单质,④溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;工段③④⑤是溴元素的富集过程,是富集溴的操作,均发生了氧化还原反应
B、氯化镁晶体脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;
C、氯碱工业电解饱和食盐水得到氯气、氢气和烧碱;
D.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,则碳酸钠放在氯化钡之后,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠无先后顺序要求.
B、氯化镁晶体脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;
C、氯碱工业电解饱和食盐水得到氯气、氢气和烧碱;
D.除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子,则碳酸钠放在氯化钡之后,盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠无先后顺序要求.
解答:
解:A、③溴离子被氧化为溴单质,④溴单质被还原为溴离子,⑤是溴元素被氧化为溴单质;此过程是富集溴的操作,均发生了氧化还原反应,故A正确;
B、工段②中的MgCl2?6H2O脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;MgCl2?6H20要在HCl氛围中加热脱水制得无水MgCl2,故B错误;
C、氯碱工业电解饱和食盐水得到氯气、氢气和烧碱,纯碱是碳酸钠,故C错误;
D.选项中的试剂添加顺序中,生成的沉淀溶解于盐酸中,镁、铁离子、钙离子离子最后无法除去,则加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故D错误;
故选A.
B、工段②中的MgCl2?6H2O脱水过程中镁离子易水解生成氢氧化镁沉淀,在氯化氢气体中脱水可以抑制镁离子水解;MgCl2?6H20要在HCl氛围中加热脱水制得无水MgCl2,故B错误;
C、氯碱工业电解饱和食盐水得到氯气、氢气和烧碱,纯碱是碳酸钠,故C错误;
D.选项中的试剂添加顺序中,生成的沉淀溶解于盐酸中,镁、铁离子、钙离子离子最后无法除去,则加入的药品顺序为:BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,故D错误;
故选A.
点评:本题考查了海水提取溴的工艺流程,氯碱工业的反应原理,掌握基础是解题关键,题目较简单.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
可逆反应2A(g)+3B(g)?2C(g)+D(g)在四种不同条件下有以下4种反应速率,则该反应在不同条件下反应速率最快的是( )
| A、v(A)=0.5mol/(L.s) |
| B、v(B)=0.6mol/(L.s) |
| C、v(C)=0.35mol/(L.s) |
| D、v(D)=0.4mol/(L.s) |
已知1mol白磷变成红磷放出18.4KJ热量,则下列2个反应中的△H1和△H2的关系正确的是( )
P4(s、白磷)+5O2(g)=2P2O5(s);△H1 4P(s、红磷)+5O2(g)=2P2O5(s);△H2.
P4(s、白磷)+5O2(g)=2P2O5(s);△H1 4P(s、红磷)+5O2(g)=2P2O5(s);△H2.
| A、△H1<△H2 |
| B、△H1>△H2 |
| C、△H1=△H2 |
| D、无法确定 |
下列反应的离子方程式正确的是( )
| A、实验室中用NH4Cl与消石灰混合加热制取NH3:NH4++OH-═NH3↑+H2O |
| B、过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O |
| C、溴化亚铁溶液中通入过量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
同学们使用的涂改液中含有很多有害的挥发性物质,二氯甲烷就是其中一种,吸入会引起慢性中毒,有关二氯甲烷的说法正确的是( )
| A、键能均相等 |
| B、键角均为109°28′ |
| C、有两种同分异构体 |
| D、该分子共含电子总数为42 |
已知NO2遇水发生反应:2NO2+H2O═HNO2+HNO3.实验证明将NO2通入水中会逸出NO气体,而通入NaOH溶液中则可完全被吸收,通入Na2CO3溶液中只逸出CO2.下列说法错误的是( )
| A、HNO2非常不稳定,其分解产物为NO和H2O |
| B、NO2与水的反应机理:NO2先与水发生岐化反应生成HNO2和HNO3,HNO2再分解 |
| C、HNO2的酸性强于碳酸的酸性 |
| D、NO2通入NaOH溶液中,生成的HNO2和HNO3都与NaOH发生中和反应 |