题目内容
已知标准状况下,4.48L某CO和CO2的混合气体的质量为6.4g.求:
(1)则混合气体中CO和CO2的物质的量分别是多少?
(2)将混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
(1)则混合气体中CO和CO2的物质的量分别是多少?
(2)将混合气体缓慢通过足量的氢氧化钠溶液后,剩余的气体是什么?其质量为多少?所含分子数为多少?
考点:物质的量的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)设CO2为x mol,CO为y mol,根据气体的物质的量之和和质量之和列等式计算;
(2)CO2和NaOH反应,CO与NaOH不反应,结合m=n?M计算质量,N=n?NA计算分子数.
(2)CO2和NaOH反应,CO与NaOH不反应,结合m=n?M计算质量,N=n?NA计算分子数.
解答:
解:(1)标准状况下:n总=
=
=0.2mol,
设CO2为x mol,CO为y mol
①44 g/mol×x+28 g/mol×y=6.4g
②x+y=0.2
①②联立解得:x=0.05 y=0.15;
答:混合气体中CO2的物质的量是0.15 mol,CO的物质的量是0.15 mol;
(2)由于CO2和NaOH反应,所以剩余的气体是CO,m(CO)=n(CO)×M(CO)=0.15 mol×28 g/mol=4.2 g,N(CO)=n(CO)×NA=0.15mol×6.02×1023mol-1=9.03×1022;
答:剩余的气体是CO,其质量为4.2 g,所含分子数为9.03×1022.
| V |
| Vm |
| 4.48L |
| 22.4L/mol |
设CO2为x mol,CO为y mol
①44 g/mol×x+28 g/mol×y=6.4g
②x+y=0.2
①②联立解得:x=0.05 y=0.15;
答:混合气体中CO2的物质的量是0.15 mol,CO的物质的量是0.15 mol;
(2)由于CO2和NaOH反应,所以剩余的气体是CO,m(CO)=n(CO)×M(CO)=0.15 mol×28 g/mol=4.2 g,N(CO)=n(CO)×NA=0.15mol×6.02×1023mol-1=9.03×1022;
答:剩余的气体是CO,其质量为4.2 g,所含分子数为9.03×1022.
点评:本题考查了混合气体的物质的量为中心的计算,题目综合性较强,涉及
=n=
=
的综合应用,注意公式使用的条件.
| V |
| Vm |
| m |
| M |
| N |
| NA |

练习册系列答案
相关题目
人体中的O2-(超氧离子)粒子对人体有害,能使人过早衰老,这是因为该离子会在人体中释放出氧化性极强的活性氧.医学界使用对人体无害的亚硒酸钠清除人体内的活性氧,这是利用亚硒酸钠的( )
| A、催化性 | B、氧化性 |
| C、还原性 | D、既有氧化性又有还原性 |
下列说法正确的是( )
| A、用新制氢氧化铜悬浊液可检验失去标签的乙醇、丙三醇、乙醛、乙酸四瓶无色溶液 |
| B、检验氯乙烷中的氯元素时,可先将氯乙烷硝酸进行酸化,再加硝酸银溶液来检验,通过观察是否有白色沉淀来判断是否存在氯元素 |
| C、摩尔盐制备过程中铁屑要先用碳酸钠溶液浸泡洗涤,使用热的碳酸钠溶液有利提高去油污的能力,最后分离溶液和固体时不可以用倾析法 |
| D、由于苯酚与溴水发生反应时,副反应多,所以只能利用溴水对含苯酚的废水作定性检验,不能用作定量测定 |
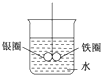 如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )
如图所示的装置,在铁圈和银圈的焊接处,用一根棉线将其悬吊在盛水的烧杯中,使之平衡.小心地向烧杯中央滴入CuSO4溶液,片刻后可观察到的现象是( )| A、铁圈和银圈左右摇摆不定 |
| B、保持平衡状况 |
| C、银圈向下倾斜 |
| D、铁圈向下倾斜 |
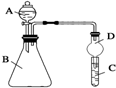 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.