题目内容
15.为了加强环境保护,工业污水必须经过处理,达到国家规定的标准后,才能排放.某化工厂A、B、C、D四个车间排放的污水分别含有污染物CuCl2、HCl、Na2CO3、NaOH中的一种,现对污水作如下处理:①将A的污水与B的蓝色污水通入第一个反应池,产生蓝色沉淀;
②将C的污水与D的酸性污水通入第二个反应池,产生大量气泡;
③将第一反应池上层的碱性污水与第二反应池流出的酸性污水通入第三个反应池,最终污水显中性,再向外排放.
(1)请你推断各车间污水的污染物分别是ANaOHBCuCl2CNa2CO3DHCl;
(2)最终向外排放的污水中含有的溶质是NaCl.
分析 (1)B中的污水是蓝色,可以知道B中含有氯化铜,A和氯化铜反应会生成沉淀,A是碳酸钠或氢氧化钠,D中的是酸性污水,所以D就是盐酸,C和盐酸反应会产生气泡,所以C中有碳酸钠,则A中就含有氢氧化钠;
(2)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,又知道第一池是碱性污水,所以第一池中的溶质有氢氧化钠和氯化钠;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,又知道第二池是酸性污水,所以第二池中的溶质有氯化氢和氯化钠,最终流出的水呈中性,说明了盐酸和氢氧化钠发生了反应,生成了氯化钠和水.
解答 解:(1)B中的污水是蓝色,可以知道B中含有氯化铜,A和氯化铜反应会生成沉淀,A是碳酸钠或氢氧化钠,D中的是酸性污水,所以D就是盐酸,C和盐酸反应会产生气泡,所以C中有碳酸钠,则A中就含有氢氧化钠,
故答案为:NaOH;CuCl2; Na2CO3;HCl;
(2)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和氯化钠,又知道第一池是碱性污水,所以第一池中的溶质有氢氧化钠和氯化钠;碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,又知道第二池是酸性污水,所以第二池中的溶质有氯化氢和氯化钠,最终流出的水呈中性,说明了盐酸和氢氧化钠发生了反应,生成了氯化钠和水,即最终向外排放的污水中含有的溶质是NaCl,
故答案为:BaCl.
点评 本题以污水处理为载体,考查无机物推断、元素化合物性质,物质的颜色及性质及反应现象为推断突破口,体现化学在社会生活实践中应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.化学变化中必然伴随着能量的变化.相同物质的量的氢原子与下列原子结合时放出能量最大的是( )
| A. | F | B. | Cl | C. | O | D. | Na |
6.室温下,pH均为12的两种溶液:①氨水.②氢氧化钠溶液.下列说法不正确的是( )
| A. | 两溶液中c(OH-):①=② | |
| B. | 两溶液的物质的量浓度:①=② | |
| C. | 两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| D. | 等体积的两溶液分别与同浓度的盐酸完全中和,消耗盐酸的体积:①>② |
3.已知化学反应①:
Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2.在温度
973K和1173K情况下,K1、K2的值分别如下:
(1)通过表格中的数值可以推断:反应①是吸热(填“吸热”或“放热”)反应.
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
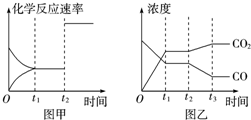
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是加入催化剂或增大体系的压强.
②图乙中t2时刻发生改变的条件是降低温度或增加水蒸气的量或减少氢气的量.
Fe(s)+CO2(g)═FeO(s)+CO(g),其平衡常数为K1;化学反应②:
Fe(s)+H2O(g)═FeO(s)+H2(g),其平衡常数为K2.在温度
973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
(2)现有反应③:CO2(g)+H2(g)=CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=$\frac{c(CO)×c({H}_{2}O)}{c(C{O}_{2})×c({H}_{2})}$.
(3)根据反应①与②可推导出K1、K2与K3之间的关系式K3=$\frac{{K}_{1}}{{K}_{2}}$.据此关系式及上表数据,也能推断出反应③是吸热(填“吸热”或“放热”)反应,要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有DF(填写序号).
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量
(4)图甲、乙分别表示反应③在t1时刻达到平衡、在t2时刻因改变某个条件而发生变化的情况:
①图甲中t2时刻发生改变的条件是加入催化剂或增大体系的压强.
②图乙中t2时刻发生改变的条件是降低温度或增加水蒸气的量或减少氢气的量.

10.“预防污染”要求我们利用各种手段减少各种污染物的排放,提高资源和能源的利用效率,绿色化学是“预防污染”的基本手段,下列各项中属于绿色化学的是( )
| A. | 处理废弃物 | B. | 治理污染点 | C. | 减少有毒物排放 | D. | 杜绝污染源 |
20.在下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | NaCl | D. | MgSO4 |
7.下列关于物质性质的说法不正确的是( )
| A. | 通常状况下,NO2是红棕色的气体 | |
| B. | 氯水光照久置后最终变为稀盐酸 | |
| C. | 氯化钙溶液和AgNO3溶液混合有白色沉淀产生 | |
| D. | 加热时,铁单质与浓硝酸不发生反应 |
5.下列说法正确的是( )
| A. | 二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) | |
| B. | 一定量的(NH4)2SO4与NH3•H2O混合的酸性溶液中:c(NH4+)>2c(SO42-) | |
| C. | 物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的溶液等体积混合后溶液中 c(CH3COOH)+c(CH3COO-)=0.02 mol/L | |
| D. | 物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中c(NH4+):①>③>② |
 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题: