题目内容
6.(1)含有6.02×1023个氧原子的H2SO4的物质的量是0.25mol(2)与标准状况下11.2L CO2所含氧原子数目相同的水的质量是18g
(3)用18mol•L-1浓H2SO4配制90mL1mol•L-1稀H2SO4,需用100mL容量瓶,需用18mol•L-1浓H2SO45.6mL (用量筒量取)
(4)若将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO 和NaClO3的混合液.当NaCl和NaClO3的物质的量之比为8:1时,混合液中NaClO 和NaClO3的物质的量之比为3:1.
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$结合硫酸分子的构成计算解答;
(2)先根据n=$\frac{V}{Vm}$求出CO2的物质的量,含有O原子相等,则n(H2O)=2n(CO2),然后再根据m=nM计算水的质量;
(3)依据配制溶液体积选择容量瓶规格,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸体积;
(4)根据氧化还原反应中电子守恒以及元素守恒来计算即可.
解答 解:(1)1个硫酸分子中含有4个氧原子,所以含有6.02×1023个氧原子的H2SO4的物质的量是$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}mol{\;}^{-1}}$×$\frac{1}{4}$=0.25mol;
故答案为:0.25;
(2)标准状况下11.2L CO2物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,要使二氧化碳与水分子含有O原子相等,则n(H2O)=2n(CO2),则n(H2O)=2×0.5mol=1mol,质量为:1mol×18g/mol=18g;
故答案为:18;
(3)用18mol•L-1浓H2SO4配制90mL1mol•L-1稀H2SO4,实验室没有90mL容量瓶,应选择100mL容量瓶,设需要浓硫酸体积为V,依据溶液稀释过程中溶质的物质的量得:18mol•L-1×V=1mol/L×100MmL,解得V=5.6mL;
故答案为:100;5.6;
(4)将Cl2通入热的烧碱溶液中,可以得到NaCl、NaClO和NaClO3的混合液.过程中氯气既是氧化剂又是还原剂,当NaCl和NaClO3的物质的量之比为8:1时,Cl原子失电子是5mol,的电子是8mol,所以NaClO的物质的量是3mol,混合液中NaClO和NaClO3的物质的量之比为3:1,
故答案为:3:1.
点评 本题考查了有关物质的量的计算,把握物质的量为中心的基本计算公式为解答的关键,注意容量瓶规格选择及氧化还原反应得失电子守恒规律,题目难度不大.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 某离子第三层上和第二层上的电子数均为第一层的 4 倍 | |
| B. | Cl-的结构示意图: | |
| C. | 某物质的焰色反应为黄色,某物质一定为钠的化合物 | |
| D. | 14C 和 14N 的质量数相等,互称为同位素 |
| A. | K越大,达到平衡时,反应进行的越完全 | |
| B. | K随反应物浓度的改变而改变 | |
| C. | K越小,达到平衡时,反应物的转化率越大 | |
| D. | K不随温度的升高而改变 |
①FeCl2
②Fe2O3
③Zn
④Fe2(SO)3
⑤AgNO3
可使铜粉溶解的是( )
| A. | ①②③ | B. | ②③④ | C. | ③④⑤ | D. | ②④⑤ |
| A. | 150mL 1mol•L-1的NaCl溶液 | B. | 75 mL 3 mol•L-1 NH4Cl溶液 | ||
| C. | 150 mL 2 mol•L-1的KCl溶液 | D. | 75 mL 2mol•L-1的FeCl3溶液 |
| A. | CuCl2溶液蒸干灼烧后得到CuCl2固体 | |
| B. | 火力发电的目的是使化学能转换为电能 | |
| C. | 已知C(石墨,s)=C(金刚石,s)△H>0,无法比较二者的稳定性. | |
| D. | 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液 |
| A. | 0.5mol/L碳酸钠溶液中含有lmolNa+ | |
| B. | 14g氮气和一氧化碳混合气体中含原子总数为NA | |
| C. | 标准状况下,2.24LCCl4物质的量为0.1mol | |
| D. | 56g铁溶于过量的盐酸,电子转移数为3NA |
(1)将相关的含硫物质分为如下表所示3组.第3组中物质X的化学式是H2SO4.
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、H2SO4、Na2SO3、NaHSO3 | SO3、X、Na2SO4、NaHSO4 |
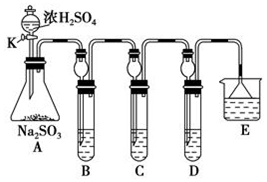
①在B中检验SO2的氧化性,则B中发生的化学反应方程式:SO2+2H2S=3S↓+2H2O.
②在C中装KMnO4溶液,目的是检验SO2的还原性,溶液逐渐褪色.生成Mn2+.同时pH降低.则C中反应的离子方程式为5SO2+2H2O+2MnO4-=5SO42-+2Mn2++4H+.
③在D中有40mL2.5mol/LNaOH溶液,反应后增重4,则装置D中发生反应的总化学方程式是5SO2+8NaOH=3Na2SO3+2NaHSO3+3H2O.
| A. | 450mL,52.65g | B. | 500mL,58.5g | C. | 450mL,117g | D. | 500mL,52.3g |