题目内容
18.在标准状况下,将5.6g铁和4.6g钠分别与100m L 1mol/L的盐酸反应,则放出H2的体积( )| A. | 钠的多 | B. | 铁的多 | ||
| C. | 铁和钠放出一样多 | D. | 无法比较 |
分析 Fe与盐酸发生反应:Fe+2HCl=FeCl2+H2↑,计算Fe、HCl的物质的量,进行过量计算,根据不足量的物质计算生成氢气的物质的量;
Na与盐酸反应,2Na+2HCl=2NaCl+H2↑,盐酸不足,发生反应2Na+2H2O=2NaOH+H2↑,根据关系式2Na~H2↑,计算生成氢气的物质的量,
相同条件下,体积之比等于物质的量之比,以此解答该题.
解答 解:n(HCl)=0.1L×1mol/L=0.1mol,
n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
n(Na)=$\frac{4.6g}{23g/mol}$=0.2mol,
Fe+2HCl=FeCl2+H2↑,盐酸不足,生成氢气0.05mol,
Na与盐酸反应,2Na+2HCl=2NaCl+H2↑,盐酸不足,发生反应2Na+2H2O=2NaOH+H2↑,由关系式2Na~H2↑,可知生成氢气的物质的量为0.1mol,
则钠生成氢气多,
故选A.
点评 本题考查根据方程式的计算,侧重于学生的分析能力和计算能力的考查,涉及过量计算,难度不大,注意Na与酸的反应,盐酸不足时Na与水反应.

练习册系列答案
相关题目
8. 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
(1)该实验的目的是探究水果种类和电极间距离对水果电池电流大小的影响.
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)如图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域的C(H+)将减少 (填“增大”“减小”“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑
(4)若反应过程中共转移1.2mol电子,则生成气体在标准状态下的体积为13.44L.
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:(已知果汁是显酸性的)| 实验编号 | 水果种类 | 电极间距离 | 电流大小/μA |
| ① | 西红柿 | 1 | 98.7 |
| ② | 西红柿 | 2 | 72.5 |
| ③ | 苹果 | 2 | 27.2 |
(2)能表明水果种类对电流大小有影响的实验编号是②和③.
(3)如图所示的装置中,负极的电极反应式为Zn-2e-=Zn2+,正极附近区域的C(H+)将减少 (填“增大”“减小”“不变”),总反应离子方程式为Zn+2H+=Zn2++H2↑
(4)若反应过程中共转移1.2mol电子,则生成气体在标准状态下的体积为13.44L.
9.pH=3和 PH=5的盐酸,等体积混合,混合后(假设体积不变)的PH为( )
| A. | 3 | B. | 3.1 | C. | 3.2 | D. | 3.3 |
3.下列叙述正确的是( )
| A. | 离子化合物不可能含有共价键 | B. | 构成晶体的粒子一定含有共价键 | ||
| C. | 共价化合物中不可能含有离子键 | D. | 分子中一定含有极性键 |
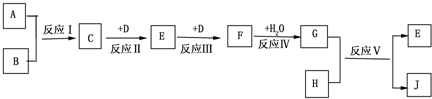


 +CH3CH2OH$\stackrel{H+}{→}$
+CH3CH2OH$\stackrel{H+}{→}$ +H2O,
+H2O, ;
; ,则H的结构简式是
,则H的结构简式是 .高聚物L由H通过肽键连接而成,写出生成L的方程式n
.高聚物L由H通过肽键连接而成,写出生成L的方程式n (或
(或 ),.
),.
 ;
;