题目内容
20. 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题(1)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是ab(填字母)
a.加水时越过刻度线
b.未洗涤烧杯和玻璃棒
c.容量瓶内壁附有水珠而未干燥处理
d.定容时俯视刻度线
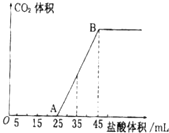
(2)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴中入1mol•L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入45mL盐酸溶液时,产生二氧化碳的物质的量为0.02mol
②计算所取氢氧化钠溶液的体积V=450mL
(3)取上述氢氧化钠溶液100mL,加入足量的铝,该反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑反应生成的气体的物质的量为0.015mol.
分析 (1)根据c=$\frac{n}{V}$计算不当操作对n或V的影响,如果n偏大或V偏小,则所配制溶液浓度偏高;
(2)由图可知,此时溶液为氯化钠,从25mL开始生成二氧化碳,反应为HCO3-+H+=CO2↑+H2O,当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,
①从25mL开始生成二氧化碳,反应为HCO3-+H+=CO2↑+H2O,生成二氧化碳消耗的盐酸为45mL-25mL=20mL,根据方程式可知n(CO2)=n(HCl),根据n=cV计算n(HCl);
②当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,根据钠元素守恒有n(NaOH)=n(NaCl),根据氯元素守恒有n(NaCl)=n(HCl),计算出n(NaOH),再根据V=$\frac{n}{c}$计算氢氧化钠溶液的体积;
(3)过量的铝与氢氧化钠反应生成Na[Al(OH)4]、H2;反应中水作氧化剂,根据n=cV计算200mL氢氧化钠溶液中n(NaOH),根据方程式计算氧化剂水的物质的量.
解答 解:(1)a.加水时越过刻度线,会造成溶液体积偏大,则浓度偏小,故a选;
b.未洗涤烧杯和玻璃棒,会造成溶质的损失,则溶液浓度偏小,故b选;
c.只要最后定容正确,容量瓶内壁附有水珠而未干燥处理对溶液体积无影响,则浓度无影响,故c不选;
d.定容时俯视刻度线,则溶液体积偏小,浓度偏高,故d不选.
故选ab;
(2)由图可知,此时溶液为氯化钠,从25mL开始生成二氧化碳,反应为HCO3-+H+=CO2↑+H2O,当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠.
①从25mL开始生成二氧化碳,反应为HCO3-+H+=CO2↑+H2O,生成二氧化碳消耗的盐酸为45mL-25mL=20mL,根据方程式可知n(CO2)=n(HCl)=0.02L×1mol•L-1=0.02mol,
故答案为:0.02;
②当加入45mL盐酸溶液时,二氧化碳的体积达最大,此时溶液中溶质为氯化钠,根据钠元素守恒有n(NaOH)=n(NaCl),根据氯元素守恒有n(NaCl)=n(HCl)=0.045L×1mol•L-1=0.045mol,所以n(NaOH)=n(NaCl=0.045mol,氢氧化钠溶液的体积为$\frac{0.045mol}{0.1mol/L}$=0.45L=450mL,
故答案为:450;
(3)过量的铝与氢氧化钠反应生成NaAlO2和H2,反应方程式为2Al+2NaOH+6H2O═2NaAlO2+3H2↑,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
反应中水作氧化剂,100mL氢氧化钠溶液中n(NaOH)=0.1L×0.1mol/L=0.01mol,根据方程式可知生成的氢气的物质的量为0.01mol×1.5=0.015mol,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;0.015mol.
点评 本题考查了一定物质的量浓度溶液的配制过程、仪器以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案| A. | 聚2-甲基-1,3-丁二烯的结构简式: | B. | 间羟基苯甲酸的结构简式: | ||
| C. | N3-的结构示意图: | D. | 氯化钡的电子式: |
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,水解程度越大 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
| A. | 硅、二氧化硅、硅酸钠是工业上制造光导纤维的主要原料 | |
| B. | 甘油不是油,油脂不是酯 | |
| C. | 煤的液化、石油分馏都是物理变化 | |
| D. | 废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源 |
| A. | C+H2O=CO+H2;△H=+131.2KJ/mol | |
| B. | CO(g)+H2(g)=C(s)+H2O(g);△H=-131.2KJ/mol | |
| C. | C(s)+H2O(g)=CO(g)+H2(g);△H=+10.93KJ/mol | |
| D. | C(s)+H2O(g)=CO(g)+H2(g);△H=-131.2KJ/mol |
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
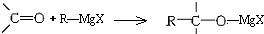 ,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )
,所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一.现欲合成(CH3)3C-OH,下列所选用的卤代烃和羰基化合物的组合正确的是( )| A. | 乙醛和氯乙烷 | B. | 甲醛和1-溴丙烷 | C. | 甲醛和2-溴丙烷 | D. | 丙酮和一氯甲烷 |