题目内容
12.反应3NO2+H2O=2HNO3+NO中,当有4mol电子发生转移时,被氧化的物质与被还原的物质的物质的量之比是( )| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 3:1 |
分析 NO2与水反应方程式3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,由产物中氮元素的化合价,可知被氧化与被还原的物质的物质的量之比为2:1,以此解答.
解答 解:NO2与水反应产生3NO2+H2O═2HNO3+NO,反应中只有氮元素的化合价发生变化,由+4价升高为+5价,由+4价降低为+2价,
所以NO2既是氧化剂也是还原剂,氧化剂被还原,还原剂被氧化,
由产物中氮元素的化合价,可知起氧化剂与还原剂的NO2物质的量之比为1:2,
所以被氧化的NO2与被还原的NO2的物质的量之比为2:1,
故选C.
点评 本题考查氧化还原反应计算、氧化还原反应概念,难度中等,理解基本概念,关键根据产物中化合价判断起氧化剂与还原剂的NO2物质的量之比.

练习册系列答案
相关题目
2.25℃时,水的电离达到平衡:H2O?H++OH-;△H>0,下列叙述正确的是( )
| A. | 向水中加入NaOH溶液,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体NaHSO4,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低? | |
| D. | 将水加热,Kw增大,pH变小 |
3.禁止用工业酒精配制饮料酒,这是因为工业酒精中常含有会使人中毒的( )
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 甲醇 |
7.熔融碳酸盐燃料电池(MCFC)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法正确的是( )
| A. | 负极反应Al-3e-Al3+ | B. | 燃料气体是氧气 | ||
| C. | 正极反应为2CO2+O2+4e-2CO32- | D. | 该电池不能用烃类物质作燃料 |
5.电池是人类生产和生活中的重要能量来源,各式各样电池的发明是化学对人类的一项重大贡献,下列有关电池的叙述正确的是( )
| A. | 锌锰干电池工作一段时间后碳棒变细 | |
| B. | 氢氧燃料电池可将热能直接转变为电能 | |
| C. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| D. | 氢氧燃料电池工作时氢气在负极被氧化 |
6.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构.例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
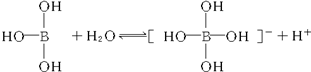
下列判断正确的是( )
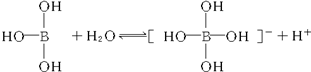
下列判断正确的是( )
| A. | 凡是酸或碱对水的电离都是抑制的 | |
| B. | 硼酸分子中除氢原子外每个其他原子最外层都满足8电子稳定结构 | |
| C. | 硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-═[B(OH)4]- | |
| D. | 硼酸是两性化合物 |
 实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题