题目内容
一种基于酸性燃料电池原理设计的酒精检测仪,电池反应的化学方程式为:CH3CH2OH+O2═CH3COOH+H2O.下列有关说法正确的是( )
| A、检测时,电解质溶液中的H+向负极移动 |
| B、若有0.4mol电子转移,则在标准状况下消耗4.48L氧气 |
| C、负极上的反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+ |
| D、正极上发生的反应为:O2+4e-+2H2O═4OH- |
考点:化学电源新型电池
专题:电化学专题
分析:酸性乙醇燃料电池的负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,正极应为O2得电子被还原,电极反应式为:O2+4e-+4H+═2H2O,正负极相加可得电池的总反应式为:CH3CH2OH+O2═CH3COOH+H2O,可根据电极反应式判断离子和电子的转移问题.
解答:
解:A.原电池中,阳离子向正极移动,则电解质溶液中的H+向正极移动,故A错误;
B.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故B错误;
C.酸性乙醇燃料电池中,乙醇在负极上失电子生成乙酸,则负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,故C正确;
D.燃料电池中,氧气在正极得电子被还原生成水,正极反应式为:O2+4e-+4H+═2H2O,故D错误.
故选:C.
B.氧气得电子被还原,化合价由0价降低到-2价,若有0.4mol电子转移,则应有0.1mol氧气被还原,在标准状况下的体积为2.24L,故B错误;
C.酸性乙醇燃料电池中,乙醇在负极上失电子生成乙酸,则负极反应为:CH3CH2OH-4e-+H2O═CH3COOH+4H+,故C正确;
D.燃料电池中,氧气在正极得电子被还原生成水,正极反应式为:O2+4e-+4H+═2H2O,故D错误.
故选:C.
点评:本题考查酸性乙醇燃料电池知识,题目难度中等,注意题中乙醇被氧化为乙酸的特点,答题中注意审题,根据题给信息解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式.下列物质通过分子间作用力形成的是( )
| A、石墨 | B、氯化钠 |
| C、氢氧化钠 | D、干冰 |
下列说法正确的是( )
| A、含有离子键的化合物一定是离子化合物 |
| B、含有共价键的化合物一定是共价化合物 |
| C、全部由非金属元素组成的化合物一定是共价化合物 |
| D、H2SO4溶于水能电离出H+和SO42-,所以H2SO4是离子化合物 |
下列表示物质结构的化学用语或模型正确的是( )
A、苯分子的比例模型: |
B、CO2的电子式: |
C、Cl-离子的结构示意图: |
| D、乙烯的结构式:CH2=CH2 |
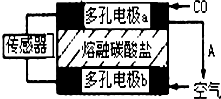
熔融盐燃料电池具有高的发电效率,因而受到重视.用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,可制得在650℃下工作的燃料电池.已知该电池总反应为:2CO+O2═2CO2.则下列说法中正确的是( )
| A、通CO的一极是电池的正极 |
| B、该电池工作过程中需不断补充CO和O2,CO2可循环利用 |
| C、负极反应式:O2+2CO2+4e-═2CO32- |
| D、该电池工作过程中有蓝色火焰产生 |
用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是 ( )(选填编号).
| A、蒸馏 |
| B、用氢氧化钠溶液洗涤 |
| C、用四氯化碳萃取 |
| D、用亚硫酸钠溶液洗涤 |
已知铅蓄电池Pb+PbO2+2H2SO4═2PbSO4+2H2O 在充电时作电解池,放电时作原电池.铅蓄电池上有两个接线柱,一个接线柱旁标有“+”,另一个接线柱旁标有“-”.下列说法中正确的是( )
| A、标有“+”的接线柱,充电时作阳极,放电时作负极 |
| B、放电时PbO2作正极,电池工作一段时间后电解质溶液密度会减少 |
| C、充电时电路中通过0.1mol电子时,电解质溶液有0.2mol H2SO4产生 |
| D、充电时阳极中PbSO4被还原为PbO2 |
下列关于电解质叙述正确的是( )
| A、CO2溶于水能部分电离,故CO2属于弱电解质 |
| B、溶于水后能电离出氢离子的化合物都是酸 |
| C、硫酸钡难溶于水,但硫酸钡属强电解质 |
| D、强电解质溶液的导电性比弱电解质溶液的导电性强 |
 2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.
2014年初,雾霾天气多次肆虐我国中东部地区.加强汽车尾气排放监测和降低有毒气体的排放对于减少雾霾具有重要的意义.